网址:http://m.1010jiajiao.com/timu_id_180782[举报]
| 卤素单质 | 密度(标准状况下) | 沸点/℃ | 熔点/℃ | 溶解度(标准状况下,100g水中) |
| A | 1.696 g?l-1 | -188.1 | -219.6 | -- |
| B | 3.214 g?l-1 | -34.6 | -101 | 226 cm3 |
| C | 3.119 g?cm-3 | 58.78 | -7.2 | 4.16 g |
| D | 4.93 g?cm-3 | 184.4 | 113.5 | 0.029 g |
(2)A的相对分子质量为
(3)写出B与水反应的化学方程式
(4)卤素单质B、C、D的氧化性由大到小的顺序为
水果成熟时,大多数香气袭人。乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质见右表。合成过程如下:第一步:将丁醇和x的混合液和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯。
| | 乙酸 | 1-丁醇 | 乙酸丁酯 |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g·cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有1-丁醇和过量的乙酸外,还装有___________、_________。装置C中冷凝管的作用是: ;
(3)乙酸过量的原因是________________。
(4)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是_____ ___ _
(5)步骤E的操作要领是:①用一只手的手掌压住分液漏斗的塞子并握住分液漏斗;②另一只手握住活塞部分;③ 。
(6)要除去乙酸丁酯中含有的少量乙酸,下列试剂中可选用的是:
A. 饱和NaOH溶液 B. 饱和KHCO3溶液
C.饱和Na2CO3溶液 D. 饱和 K2CO3溶液
E. 饱和KOH溶液 F.过量的 1-丁醇 查看习题详情和答案>>
【化学――选修物质结构与性质】(15分)
有A、B、C、D、E五种元素。其相关信息如下:

请回答下列问题。
(1) 写出E元素原子基态时的电子排布式__________________;
(2) C元素的第一电离能比氧元索的第一电离能 ______ ______ (填“大”或“小”);
(3) CA3分子中C原子的杂化轨道类型是____________;
(4) A、C、E三种元素可形成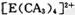 配离子,其中存在的化学键类型有 ______ (填序号);
配离子,其中存在的化学键类型有 ______ (填序号);
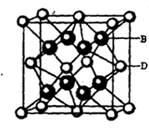
①配位键 ②金属键③极性共价键④非极性共价键⑤离子键 ⑥氢键
若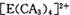 具有对称的空间构型,且当
具有对称的空间构型,且当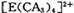 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则
中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则 的空间构型为 ______ ______ (填序号);
的空间构型为 ______ ______ (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d. V型
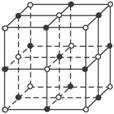
(5) B与D可形成离子化合物,其晶胞结构如右图所示。其中D离子的配位数为_____,若该晶体的密度为ag • cm-3,则该晶胞的体积是______cm-3 (写出表达式即可)。
查看习题详情和答案>>
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个Na+最近的Na+有____________个。若晶体密度为ρ g·cm-3,阿伏加德罗常的值用NA表示,则Cl-的离子半径_____cm(用含NA与ρ式子表达)。
查看习题详情和答案>>