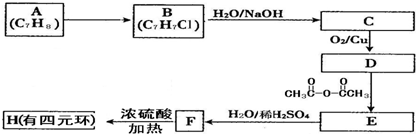
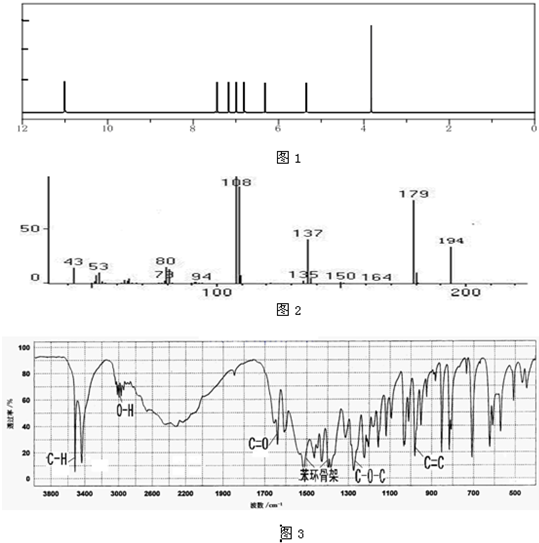
题目内容
A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.
(1)在标准状况下为液体的卤素单质是
(2)A的相对分子质量为
(3)写出B与水反应的化学方程式
(4)卤素单质B、C、D的氧化性由大到小的顺序为
| 卤素单质 | 密度(标准状况下) | 沸点/℃ | 熔点/℃ | 溶解度(标准状况下,100g水中) |
| A | 1.696 g?l-1 | -188.1 | -219.6 | -- |
| B | 3.214 g?l-1 | -34.6 | -101 | 226 cm3 |
| C | 3.119 g?cm-3 | 58.78 | -7.2 | 4.16 g |
| D | 4.93 g?cm-3 | 184.4 | 113.5 | 0.029 g |
C
C
(填字母,下同),为固体的卤素单质是D
D
.(2)A的相对分子质量为
38
38
(保留整数)(3)写出B与水反应的化学方程式
Cl2+H2O═HCl+HClO
Cl2+H2O═HCl+HClO
(4)卤素单质B、C、D的氧化性由大到小的顺序为
Cl2>Br2>I2
Cl2>Br2>I2
(用化学式表示)分析:(1)根据卤素单质的熔点、沸点来判断物质的状态;
(2)根据M=ρ×Vm求出摩尔质量,利用摩尔质量和相对分子质量在数值上相等;
(3)根据题目信息得出B为Cl2,再根据氯气与水反应写出方程式;
(4)根据同一主族从上到下,单质的氧化性逐渐减弱;
(2)根据M=ρ×Vm求出摩尔质量,利用摩尔质量和相对分子质量在数值上相等;
(3)根据题目信息得出B为Cl2,再根据氯气与水反应写出方程式;
(4)根据同一主族从上到下,单质的氧化性逐渐减弱;
解答:解:(1)因卤素单质A、B的沸点比常温(25℃)低,所以在常温下为气态,卤素单质C的熔点比常温高,但沸点比常温低,所以在常温下为液态,卤素单质D的熔点比常温高,所以在常温下为固态,故答案为:C;D;
(2)因M=ρ×Vm=1.696g?l-1×22.4L/mol=38g/mol,所以A的相对分子质量为38,故答案为:38;
(3)因B为Cl2,氯气能与水反应:Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO;
(4)因同一主族从上到下,单质的氧化性逐渐减弱,所以Cl2>Br2>I2,故答案为:Cl2>Br2>I2.
(2)因M=ρ×Vm=1.696g?l-1×22.4L/mol=38g/mol,所以A的相对分子质量为38,故答案为:38;
(3)因B为Cl2,氯气能与水反应:Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO;
(4)因同一主族从上到下,单质的氧化性逐渐减弱,所以Cl2>Br2>I2,故答案为:Cl2>Br2>I2.
点评:本题主要考查了卤素单质的性质,结合图表培养了学生分析问题、解决问题的能力.

练习册系列答案
相关题目
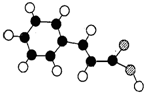
 (1)肉桂酸(E)的分子结构模型如右图所示(图中球与球之间连线表示单键或双键).
(1)肉桂酸(E)的分子结构模型如右图所示(图中球与球之间连线表示单键或双键).


 +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O
 +H2O
+H2O