摘要:(4)2KMnO4+8H2SO4+5Na2C2O42MnSO4+K2SO4+10CO2↑+5Na2SO4+8H2O中的化学方程式:2KMnO4――――――――5Na2C2O42×158 5×134
网址:http://m.1010jiajiao.com/timu_id_180773[举报]
用下列方法均可制取氧气:
(1)2KClO3
2KCl+3O2↑
(2)2Na2O2+2H2O═4NaOH+O2↑
(3)2HgO
2Hg+O2↑
(4)2KMnO4═K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
(1)2KClO3
| MnO2 |
(2)2Na2O2+2H2O═4NaOH+O2↑
(3)2HgO
| ||
(4)2KMnO4═K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
| A、3:2:l:4 |
| B、l:1:l:l |
| C、2:l:2:2 |
| D、l:2:l:l |
某研究性学习小组为研究氯气是否具有漂白性,设计如下实验装置.试根据实验装置回答下列问题:

A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液
(1)在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的 .
(2)B中的液体为 ,其作用为 .
(3)A、C中有色布条的颜色变化分别为 ,A、C的实 验现象说明氯气是否具有漂白性? (填“是”或“否”).
(4)D中NaOH溶液的作用 (用离子方程式说明).
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去.组内有甲、乙两种 意见:
甲:氯气溶于水溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色.
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则 的意见正确.(填“甲”或“乙”)
查看习题详情和答案>>

A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液
(1)在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的
(2)B中的液体为
(3)A、C中有色布条的颜色变化分别为
(4)D中NaOH溶液的作用
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去.组内有甲、乙两种 意见:
甲:氯气溶于水溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色.
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则
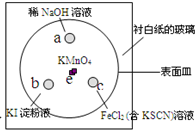 (2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.
(2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.已知反应中有关物质的转化过程为:
KMnO4→MnCl2;
HCl→Cl2
(1)e 处的化学反应方程式为
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
该反应中氧化剂与还原剂的物质的量之比为_1:5
1:5
,电子转移的数目为10
10
.(2)b处的实验现象为
溶液变蓝色
溶液变蓝色
,c处的实验现象为溶液变红色
溶液变红色
.(3)a处的反应方程式为
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)通过该实验可比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是
KMnO4>Cl2>FeCl3
KMnO4>Cl2>FeCl3
.草酸晶体的组成可表示为H2C2O4?xH2O,为测定x值,进行下列实验.
①称取m g草酸晶体,配成100.0mL溶液.
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol?L-1 KMnO4溶液滴定.滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙和
(2)在实验②中,滴定时KMnO4溶液应装在
(3)在滴定过程中,目光应注视
(4)若滴定时,滴定前后两次读数分别为amL和bmL,因此计算出草酸晶体x值为
-5
-5.
(5)若读取读数a时仰视,读取读数b时俯视,则所测x值
查看习题详情和答案>>
①称取m g草酸晶体,配成100.0mL溶液.
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol?L-1 KMnO4溶液滴定.滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙和
100mL容量瓶
100mL容量瓶
、胶头滴管
胶头滴管
、玻璃棒
玻璃棒
.(2)在实验②中,滴定时KMnO4溶液应装在
酸
酸
式滴定管中,锥形瓶中不需要
不需要
(填“需要”或“不需要”)滴加指示剂.(3)在滴定过程中,目光应注视
锥形瓶中溶液颜色的变化
锥形瓶中溶液颜色的变化
.(4)若滴定时,滴定前后两次读数分别为amL和bmL,因此计算出草酸晶体x值为
| 50m |
| 9c?(b-a) |
| 50m |
| 9c?(b-a) |
(5)若读取读数a时仰视,读取读数b时俯视,则所测x值
偏大
偏大
(填“偏大”、“偏 小”或“不变”).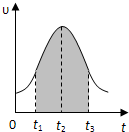 I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.回答如下问题:
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.回答如下问题:(1)该反应的化学方程式:
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
(2)0→t2时间段内反应速率增大的原因是:
反应放热,温度升高,反应速率加快
反应放热,温度升高,反应速率加快
,(3)t2→t时间段内反应速率减小的原因是:
反应物浓度降低,导致反应速率降低
反应物浓度降低,导致反应速率降低
,(4)图中阴影部分“面积”表示t1→t3时间里
AD
AD
.A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

(1)定性分析:如图甲可观察
产生气泡的快慢
产生气泡的快慢
,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰
消除阴离子不同对实验的干扰
.(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为
分液漏斗
分液漏斗
,实验中需要测量的数据是产生40mL气体所需的时间
产生40mL气体所需的时间
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示.设放出气体的总体积为V mL.
①放出
| V | 3 |
1
1
min.②该H2O2溶液的浓度为
0.09mol/L
0.09mol/L
③A、B、C、D各点反应速率快慢的顺序为
D
D
>C
C
>B
B
>A
A
.