题目内容
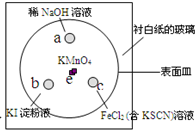 (2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.
(2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.已知反应中有关物质的转化过程为:
KMnO4→MnCl2;
HCl→Cl2
(1)e 处的化学反应方程式为
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
该反应中氧化剂与还原剂的物质的量之比为_1:5
1:5
,电子转移的数目为10
10
.(2)b处的实验现象为
溶液变蓝色
溶液变蓝色
,c处的实验现象为溶液变红色
溶液变红色
.(3)a处的反应方程式为
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)通过该实验可比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是
KMnO4>Cl2>FeCl3
KMnO4>Cl2>FeCl3
.分析:(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,据此写出反应方程式;高锰酸钾是氧化剂盐酸是还原剂,根据高锰酸钾和参加氧化还原反应的盐酸的计量数判断氧化剂和还原剂的物质的量之比,根据化合价变化判断转移电子数目;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,c处氯气能氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,c处氯气能氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
解答:解:(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,所以发生的反应方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中氧化剂是高锰酸钾,还原剂是盐酸,根据转移电子守恒知,当2mol高锰酸钾参加反应时,参加氧化还原反应的盐酸的物质的量是10mol,所以氧化剂和还原剂的物质的量之比=2:10=1:5,转移电子数目=2(7-2)=10,
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;1:5;10;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,c处氯气能氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色,所以b处看到的现象是溶液变蓝色,c处看到的现象是溶液变红色,故答案为:溶液变蓝色;溶液变红色;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中氧化性KMnO4>Cl2,2FeCl2+Cl2=2FeCl3中氧化性Cl2>FeCl2,所以氧化性大小顺序是KMnO4>Cl2>FeCl3,
故答案为:KMnO4>Cl2>FeCl3.
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;1:5;10;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,c处氯气能氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色,所以b处看到的现象是溶液变蓝色,c处看到的现象是溶液变红色,故答案为:溶液变蓝色;溶液变红色;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中氧化性KMnO4>Cl2,2FeCl2+Cl2=2FeCl3中氧化性Cl2>FeCl2,所以氧化性大小顺序是KMnO4>Cl2>FeCl3,
故答案为:KMnO4>Cl2>FeCl3.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,知道常见的氧化剂及还原剂,会根据方程式判断物质氧化性强弱,难度不大.

练习册系列答案
相关题目
 (2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )
(2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )