题目内容
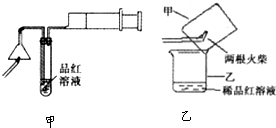
某研究性学习小组为研究氯气是否具有漂白性,设计如下实验装置.试根据实验装置回答下列问题:
A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液
(1)在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的
(2)B中的液体为
(3)A、C中有色布条的颜色变化分别为
(4)D中NaOH溶液的作用
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去.组内有甲、乙两种 意见:
甲:氯气溶于水溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色.
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则
分析:(1)高锰酸钾固体和浓盐酸反应制备氯气,反应不需要加热,为固体与液体反应,据此结合图象判断;
(2)浓硫酸具有吸水性,能吸收氯气中的水蒸气;
(3)能使有色布条褪色的物质是次氯酸;潮湿的氯气能使有色布条褪色,干燥氯气不能使有色布条褪色;
(4)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(5)继续滴加碱,若红色恢复说明酸碱中和使碱减少,若红色不恢复,则说明是次氯酸的作用.
(2)浓硫酸具有吸水性,能吸收氯气中的水蒸气;
(3)能使有色布条褪色的物质是次氯酸;潮湿的氯气能使有色布条褪色,干燥氯气不能使有色布条褪色;
(4)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(5)继续滴加碱,若红色恢复说明酸碱中和使碱减少,若红色不恢复,则说明是次氯酸的作用.
解答:解:(1)高锰酸钾固体和浓盐酸反应制备氯气,反应不需要加热,为固体与液体反应,且氯气能溶于水,甲装置适用于固体和液体加热制备气体,乙装置适用于固体和液体反应,要求固体难溶于水且生成的气体难溶于水,丙装置适合,故选丙,
故答案为:丙;
(2)浓硫酸具有吸水性,且浓硫酸和氯气不反应,所以浓硫酸的作用是干燥氯气,
故答案为:浓硫酸;干燥氯气或吸收氯气中的水蒸气;
(3)高锰酸钾固体和浓盐酸反应生成的氯气中有水蒸气,进入A中,氯气和水蒸气反应生成盐酸和次氯酸,HClO有漂白性,A中有色布条褪色,B中浓硫酸具有吸水性干燥氯气,干燥氯气不能使有色布条褪色,所以C中有色布条不褪色,A、C的实验现象不能说明氯气具有漂白性,
故答案为:A中有色布条褪色,C中有色布条不褪色;否;
(4)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)因在褪色后的溶液中逐渐加入足量的NaOH溶液,因溶液中有酚酞,碱性溶液应显红色,溶液一直未见红色,说明氯气溶于水生成漂白性物质,使溶液褪为无色,不是由于碱被中和褪色,故乙正确,
故答案为:乙.
故答案为:丙;
(2)浓硫酸具有吸水性,且浓硫酸和氯气不反应,所以浓硫酸的作用是干燥氯气,
故答案为:浓硫酸;干燥氯气或吸收氯气中的水蒸气;
(3)高锰酸钾固体和浓盐酸反应生成的氯气中有水蒸气,进入A中,氯气和水蒸气反应生成盐酸和次氯酸,HClO有漂白性,A中有色布条褪色,B中浓硫酸具有吸水性干燥氯气,干燥氯气不能使有色布条褪色,所以C中有色布条不褪色,A、C的实验现象不能说明氯气具有漂白性,
故答案为:A中有色布条褪色,C中有色布条不褪色;否;
(4)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)因在褪色后的溶液中逐渐加入足量的NaOH溶液,因溶液中有酚酞,碱性溶液应显红色,溶液一直未见红色,说明氯气溶于水生成漂白性物质,使溶液褪为无色,不是由于碱被中和褪色,故乙正确,
故答案为:乙.
点评:本题考查氯气的性质与实验室制备,掌握氯气实验室制备的原理与注意事项以及氯水的漂白原理是解答本题的关键,题目难度中等.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
某研究性学习小组根据侯德榜制碱法原理并参考下表有关物质溶解度(g/100g水)数据,以饱和NaCl溶液与研细的NH4HCO3为原料,设计实验经两步反应制备纯碱.
下列有关说法中,正确的是( )
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 35℃以上分解 | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| A、第一、二步反应的基本类型为化合反应、分解反应 |
| B、第一、二步反应之间的主要实验操作是过滤、洗涤 |
| C、第一步反应控制温度高于30℃目的是提高反应产率 |
| D、反应液加盐酸处理可使NaCl循环使用并回收NH4Cl |
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.