网址:http://m.1010jiajiao.com/timu_id_175947[举报]
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,a的分子式是
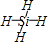
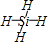
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)
(4)Y与Z比较,电负性较大的是
(5)W的元素符号是
(1)Y与Z可分别与X形层只含一个中心原子的共价化合物a、b,它们的分子式分别是
(2)在X和Y的氧化物中,属于非极性分子的是(填分子式)
(3)Y与Z比较,电负性较大的是
(4)W的元素符号是
 (2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.
(2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.(1)上述反应的催化剂常用第四周期两种金属元素的化合物,其中一种元素的原子L层电子数与最外层电子数之比为4:1,d轨道中的电子数与最外层电子数之比为5:1,它的元素符号为
(2)根据等电子原理,写出CO分子的结构式
(3)甲醇催化氧化可得到甲醛.
①甲醇的沸点比甲醛的高,其主要原因是
②甲醛分子中碳原子轨道的杂化类型为
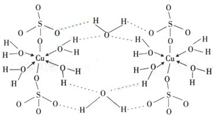
(4)上述反应的催化剂另一种是铜元素的化合物.已知铜的重要化合物胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如:下列说法正确的是
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去.
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z原子与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_____、_______;杂化轨道分别是________、_________;a分子的立体结构是____________;
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体;
(3)X的氧化物与Y的氢化物中,分子极性较小的是(填分子式) ;
(4)Y与Z比较,电负性较大的是____________;
(5)W的元素符号是 ,其+2价离子的核外电子排布式是 。
查看习题详情和答案>>
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是__________________、_____________________;杂化轨道分别是_________________、_________________;a分子的立体结构是_________________;
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是______________晶体、_______________晶体;
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)_________________;
(4)Y与Z比较,电负性较大的是(填元素符号)_________________;
(5)W的元素符号是____________,其+2价离子的核外电子排布式是_________________。
查看习题详情和答案>>