摘要:[物质结构与性质]元素周期表中第四周期元素由于受3d电子的影响.性质的递变规律与短周期元素略有不同.(1)第四周期过渡元素的明显特征是形成多种多样的配合物.① CO可以和很多过渡金属形成配合物.如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子.C.O原子都符合8电子稳定结构.CO的结构式为 .与CO互为等电子体的离子为 .② 金属镍粉在CO气流中轻微加热.生成液态Ni(CO)4分子.423K时.Ni(CO)4分解为Ni和CO.从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列 .a. 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液(2)第四周期元素的第一电离能随原子序数的增大.总趋势是逐渐增大的.镓的基态原子的电子排布式是 .Ga的第一电离能却明显低于Zn.原因是 .(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构.两个结论都正确的是 .a.直线形,三角锥形 b.V形,三角锥形 c.直线形,平面三角形 d.V形,平面三角形 题号12345678答案CDDABDBD题号91011121314--------------答案CBCAACDAB-------------- 南京市鼓楼区2009届高三上学期期中考试
网址:http://m.1010jiajiao.com/timu_id_175484[举报]
15、(12分) (1)Mg2+、Al3+、NO 、SO
、SO (4分)
(4分)
(2)Fe2+、Ba2+、I-、HCO (4分)
(4分)
(3)焰色反应,取少量原溶液,加入Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3(4分)
16、⑴C、D、F、E; ⑵10;⑶浓硫酸,干燥SO2 ⑷A、D ⑸⑤
⑹42%(或0.42);NaCl、Na2SO4
17、I.(1)溶液显色所需要的时间。
(2)①2NO+O2+4CO 4CO2+N2(3分);②-1160 kJ?mol-1;
4CO2+N2(3分);②-1160 kJ?mol-1;
(3)①该研究只能提高化学反应速率,不能使化学平衡发生移动、 D
II.NO2(2)NH4NO3 N2O+2H2O(3分)
N2O+2H2O(3分)
18、 (1) 、
、 、Mg2+(2)氟,2H2O+
、Mg2+(2)氟,2H2O+
(3)  2CO↑+Si (4)2Mg+CO2
2CO↑+Si (4)2Mg+CO2 2MgO+C
2MgO+C
19、Ⅰ.
 Ⅱ.(1)HgCl2 HgCl++Cl―(1分);
Ⅱ.(1)HgCl2 HgCl++Cl―(1分);
2Fe2++2HgCl2=Hg2Cl2↓+2Fe3++2Cl―(2分);
K=[Fe3+]2―[Cl―]2/[Fe2+]2[HgCl2]2(2分)
(2)不能。因为加热能促进氯化铝水解,且氯化氢逸出也使平衡
 )(2分)(2)②③(2分)(3)3(2分)(4)
)(2分)(2)②③(2分)(3)3(2分)(4) (2分)
(2分) (3分)
(3分) (3分)
(3分)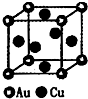

 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。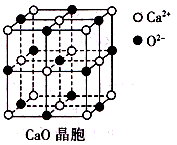
 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。