题目内容
【化学一物质结构与性质】元素周期表中第四周期元素由于受3d电子的影 响,性质的递变规律与短周期元素略有不同,因此第四周期过渡元素具有和短周期元素不同的明显特征.
请回答下列问题:
(1)CO可以和很多过渡金属形成配合物,CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子里的共价键的类型按原子轨道的重叠方向分有
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.但
Ga 的第一电离能却明显低于
Zn,其原因是 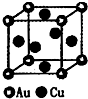
(3)如图是金与铜形成的金属互化物合金,它的化学式可表示为
(4)已知Ti3+可形成配位数为6的配合物;现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体 的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体样品配成待测溶液;
b.分别向待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水 溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
.
则绿色晶体配合物的化学式为
(5)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
A.苯与B3N3H6互为等电子体
B.甲醛、苯和二氧化碳中碳原子均采用Sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲酸高得多,是因为水分子间形成了氢键.
请回答下列问题:
(1)CO可以和很多过渡金属形成配合物,CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子里的共价键的类型按原子轨道的重叠方向分有
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.但
31 |
30 |

(3)如图是金与铜形成的金属互化物合金,它的化学式可表示为
(4)已知Ti3+可形成配位数为6的配合物;现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体 的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体样品配成待测溶液;
b.分别向待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水 溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
则绿色晶体配合物的化学式为
(5)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
A.苯与B3N3H6互为等电子体
B.甲醛、苯和二氧化碳中碳原子均采用Sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲酸高得多,是因为水分子间形成了氢键.
分析:(1)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键,结构式为C≡O,三键中含有1个σ键,2个π键;
(2)Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,第一电离能较高;
(3)利用均摊法计算晶胞中含有的原子数;
(4)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子;
(5)A.苯与B3N3H6价电子总数相等,原子数也相等互为等电子体;
B.甲醛分子的空间结构不对称属于极性分子;
C.甲醛、苯分子中碳原子均含有3个δ键,没有孤对电子,采用sp2杂化,;
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键;
(2)Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,第一电离能较高;
(3)利用均摊法计算晶胞中含有的原子数;
(4)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
(5)A.苯与B3N3H6价电子总数相等,原子数也相等互为等电子体;
B.甲醛分子的空间结构不对称属于极性分子;
C.甲醛、苯分子中碳原子均含有3个δ键,没有孤对电子,采用sp2杂化,;
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键;
解答:解:(1)C、O原子都符合8电子稳定结构,结构式为C≡O,CO分子里的共价键的类型按原子轨道头碰头的重叠方式有σ键,按肩并肩的重叠方式有π键;
故答案为:σ键,π键;
(2)Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高;
故答案为:Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高;
(3)该晶胞中含金原子个数=8×
=1,含有铜原子个数=6×
=3,所以其化学式为Cu3Au或AuCu3;
故答案为:Cu3Au或AuCu3;
(4)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子,即绿色晶体的化学式为[TiCl(H2O)5]Cl2?H2O,
故答案为:[TiCl(H2O)5]Cl2?H2O.
(5)A.苯与B3N3H6价电子总数相等,原子数也相等互为等电子体,故A正确;
B.甲醛分子的空间结构不对称属于极性分子,故B错误;
C.甲醛、苯分子中碳原子均含有3个δ键,没有孤对电子,采用sp2杂化,故C正确;
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键,故D正确;
故答案为:ACD;
故答案为:σ键,π键;
(2)Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高;
故答案为:Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高;
(3)该晶胞中含金原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:Cu3Au或AuCu3;
(4)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
故答案为:[TiCl(H2O)5]Cl2?H2O.
(5)A.苯与B3N3H6价电子总数相等,原子数也相等互为等电子体,故A正确;
B.甲醛分子的空间结构不对称属于极性分子,故B错误;
C.甲醛、苯分子中碳原子均含有3个δ键,没有孤对电子,采用sp2杂化,故C正确;
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键,故D正确;
故答案为:ACD;
点评:本题考查了物质结构和性质,涉及电子排布式的书写、原子杂化类型的判断、空间构型的判断等知识点,考查的知识点较多,难度较大,难点是配位数的判断,注意相关知识的积累.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
(13分)【化学一物质结构与性质】
A、B、M、X、Y、Z是元素周期表中的前 20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
| A的最简单氢化物 | B的最简单氢化物 | M的最简单氢化物 | X的氧化物 | Y的最简单氢化物 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 分子呈正四面体构型 | 对应水化物为最强酸 |
(1)写出X原子的电子排布式 。
(2)A、B、M电负性由大到小的排列顺序为 。
(3)Y的最简单氢化物中,Y原子的杂化形式是 。
(4)B的最简单氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”)。
(5)比较熔点高低:A最高价氧化物的熔点 Y最高价氧化物的熔点。
(6)判断沸点高低:M氢化物的沸点 Z氢化物的沸点,原因是 。
(13分)【化学一物质结构与性质】
A、B、M、X、Y、Z是元素周期表中的前20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
|
A的最简单氢化物 |
B的最简单氢化物 |
M的最简单氢化物 |
X的氧化物 |
Y的最简单氢化物 |
Z的最高价氧化物 |
|
含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
分子呈正四面体构型 |
对应水化物为最强酸 |
回答下列问题
(1)写出X原子的电子排布式 。
(2)A、B、M电负性由大到小的排列顺序为 。
(3)Y的最简单氢化物中,Y原子的杂化形式是 。
(4)B的最简单氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”)。
(5)比较熔点高低:A最高价氧化物的熔点 Y最高价氧化物的熔点。
(6)判断沸点高低:M氢化物的沸点 Z氢化物的沸点,原因是 。

 (2013?德州一模)【化学一物质结构与性质】
(2013?德州一模)【化学一物质结构与性质】