摘要:3Mg+N2Mg3N2 Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑练习题目
网址:http://m.1010jiajiao.com/timu_id_17545[举报]
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是
(3)D和Y形成的化合物,其分子的空间构型为
(4)D和X形成的化合物,其化学键类型属
(5)金属镁和E的单质在高温下反应得到的产物是
查看习题详情和答案>>
(1)Y的最高价氧化物的化学式为
SO3
SO3
.(2)上述5种元素中,能形成酸性最强的含氧酸的元素是
Cl
Cl
,写出该元素的最高价含氧酸的化学式:HClO4
HClO4
.(3)D和Y形成的化合物,其分子的空间构型为
直线型
直线型
.(4)D和X形成的化合物,其化学键类型属
极性共价键
极性共价键
,其晶体类型属原子晶体
原子晶体
.(5)金属镁和E的单质在高温下反应得到的产物是
Mg3N2
Mg3N2
,此产物与水反应生成两种碱,该反应的化学方程式是Mg3N2+8H2O=3Mg(OH)2+2NH3.H2O
Mg3N2+8H2O=3Mg(OH)2+2NH3.H2O
.我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:
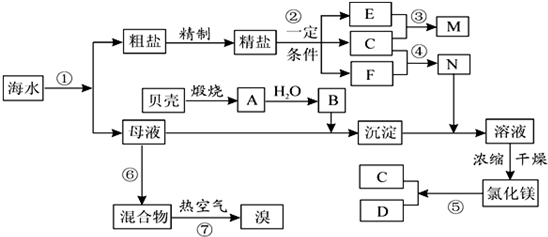
请根据以上信息回答下列问题:
I(1)写出N的化学式和B的名称:N
(2)写出反应②的化学方程式
(3)写出反应③的离子方程式:
Ⅱ粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为
A.②③④①B.③④②①C.④③②①D.③②④①
Ⅲ提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2.
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是
A.分解反应B.化合反应C.置换反应 D.复分解反应
(2)氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体.但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩.试用化学反应方程式解释不选用氮气的原因:
(3)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是
A.从外地购买B.在当地新建生产厂
C.从本厂生产烧碱处循环D.从本厂生产镁单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有
(4)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?
查看习题详情和答案>>

请根据以上信息回答下列问题:
I(1)写出N的化学式和B的名称:N
HCl
HCl
、B石灰乳
石灰乳
.(2)写出反应②的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
(3)写出反应③的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
,Ⅱ粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为
AD
AD
.A.②③④①B.③④②①C.④③②①D.③②④①
Ⅲ提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2.
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是
C
C
.A.分解反应B.化合反应C.置换反应 D.复分解反应
(2)氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体.但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩.试用化学反应方程式解释不选用氮气的原因:
3Mg+N2
Mg3N2
| ||
3Mg+N2
Mg3N2
.
| ||
(3)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是
CD
CD
.A.从外地购买B.在当地新建生产厂
C.从本厂生产烧碱处循环D.从本厂生产镁单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有
挥发
挥发
性.(4)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?
乙
乙
(填“甲”或“乙”),理由是若先提取镁,海水中会残留大量Ca(OH)2,再用Cl2提取溴时会消耗大量Cl2
若先提取镁,海水中会残留大量Ca(OH)2,再用Cl2提取溴时会消耗大量Cl2
.