网址:http://m.1010jiajiao.com/timu_id_174558[举报]
根据下表数据,请回答下列问题:
| 化学键 | Si―O | Si―Cl | H―H | H―Cl | Si―Si | Si―C |
| 键能/ KJ?mol―1 | 460 | 360 | 436 | 431 | 176 | 347 |
⑴ 比较下列两组物质的熔点高低 (填>或<= SiC______ Si; SiCl4 ______ SiO2
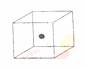
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g) ![]() Si(s) + 4HCl(g) 该反应的反应热△H = ______ KJ/mol
Si(s) + 4HCl(g) 该反应的反应热△H = ______ KJ/mol
| |||||||||||||||
A. 离子晶体中一定存在离子键,分子晶体中一定存在共价键
B. 主族元素形成的单质,从上到下熔沸点逐渐升高
C. N2分子中的共价键是由两个σ键和一个π键组成的
D. 以极性键结合的分子不一定是极性分子
(2)下列叙述正确的是____。
A. 用VSEPR理论预测PCl3的立体构型为平面三角形
B. SO2和CO2都是含有极性键的非极性分子
C. 在NH4+和[Cu(NH3)2]2+中都存在配位键
D. 铝元素的原子核外共有5种不同运动状态的电子
Q、R、X、Y、Z五种元素的原子序数逐渐增大。已知Z的原子序数为29,其余均为短周期主族元素。Y 原子的价电子排布为msnmpn,R原子核外L层的电子数为奇数,Q、X原子p轨道的电子数分别为2和4。 请回答下列问题:
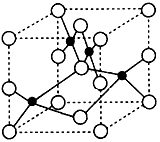
(3)Z2+的核外电子排布式是______________。如图是Z和X形成晶体的晶胞结构示意图(○代表X),可确定该品胞中阴离子的个数为___________。
(5)Q和X形成的一种化合物甲的相对分子质量为44,则甲的空间构型是_____________。中心原子采取的杂化轨道类型是____,该分子中含有____个π键。
(6)R有多种氧化物,其中乙的相对分子质量最小。在一定条件下,2L的乙气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是_________。
(7)这五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于____ 晶体;Q、R、X三种元素的第一电离能数值由小到大的顺序为____(用元素符号作答)。
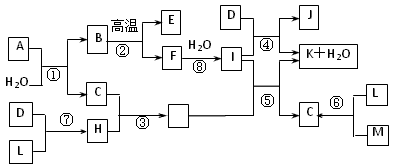
(1)物质E的结构式为__________。
(2)属于化合反应,但不属于氧化还原反应的是__________(用编号填空)。
(3)C、H的熔沸点比较:C___H(填““>”、“<”或“=”))原因是:_________________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为 ______________。
(5)在一定温度下,有甲、乙两容积相等的密闭容器。
I.向甲容器中通入3 mol M和4 mol L,反应达到平衡时,生成C的物质的量为a mol。此时,M的转化率为__________。下列能提高反应物L的转化率,但实际生产过程中并没有采用的措施是_____________。
①降低合成塔温度 ②适当增大压强 ③不断分离出产物C ④加入合适催化剂
II.向乙中通入2 mol C,欲使反应达到平衡时,各物质的浓度与I中第一次平衡时相同,则起始时还需通入__________mol M和__________mol L。
III.若起始时,向乙中通入6mol M和8mol L,达到平衡时,生成C的物质的量为b mol,则a/b______1/2(选填“>”、“<”或“=”)。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.60 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +2 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
根据上表回答下列问题:
(1)C、I的氢化物可相互混溶在一起,请解释其可能的原因
;
(2) 写出E的单质与I元素的最高价氧化物对应的水化物反应的化学方程式:
;
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 (写分子式);元素E、H、I形成的化合物HEI,其电子式为
,该化合物中共形成 个σ键, 个π键;
(4)元素B、D、H与C组成的化合物B2C、DC、H2C的熔点高低顺序为 ,其原因是 ;
(5)A和J相比较,非金属性较弱的是 (填元素名称),可以验证你的结论的是下列中的 (填编号)。
a.氢化物中X—H键的键长(X代表A和J两元素) b.单质分子中的键能
c.两单质在自然界的存在 d.含氧酸的酸性
e.气态氢化物的稳定性和挥发性 f.两元素的电负性
查看习题详情和答案>>
