网址:http://m.1010jiajiao.com/timu_id_174452[举报]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
C
A
B
B
D
C
B
C
A
AB
AD
C
BD
AD
15.(14分)(1)66.7%(2分), 46.7%(2分),
6 (NH2)2CO → C3H6N6 + 6 NH3 + 3 CO2(2分)
②C3H6N6+3H2O=C3N3(OH)3+3NH3
(2) ①N2H4+H2O NH2NH3+(N2H5+)+OH- (2分)
NH2NH3+(N2H5+)+OH- (2分)
(NH2NH3++
H2O NH3NH32++OH- )
NH3NH32++OH- )
② CO(NH2)2+ NaClO+ 2NaOH = N2H4+NaCl+Na2CO3 +H2O (2分)
③N2H4(l)+O2(l)=N2(g)+2H2O(l) ΔH=-621.23 kJ?mol-1 (2分)
16.(10分)(1)量筒 22.80 (2分)
(2)①,0.6(1分)酚酞(1分)② 无色溶液变成浅红色,且半分钟内不褪色(2分)
③c(NaOH)= (2分)
(2分)
④B(2分)
17. ⑴Na+[ ]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2O Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
18. (1)Al
(2)① C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
② NO CO2
(3)Cu2+ Fe3+ H+
(4)2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
(5)CuO、C; CuO、C、Fe2O3
19. ⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I― == 2Fe2+ + I2
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1 3
20.(1)吸热(2)1/9,1/7(3)2NO+O2+4CO=4CO2+N2
21.(12分)(1) 0.75mol/L (3分)
(2)Na2CO3,NaOH ;(3分) 1:3 。(3分)
(3) 112 mL。(3分)
为测定月球上钛铁矿的组成,称取1.53g样品,在高温下通入足量的H2还原,并最终收集到0.180g水.将反应后残渣加入足量浓氢氧化钠溶液中,充分溶解后过滤,将所得滤渣洗涤、烘干后称量得0.570g;将滤渣的一半溶于过量的稀硝酸,并过滤除去0.0100g不溶物后配制成50.0mL溶液;向其一半溶液中加入少许KSCN溶液,显红色;余下的25.0mL溶液中如果加入过量NaOH稀溶液,则生成红褐色沉淀,将沉淀过滤洗涤、灼烧后得0.200g固体.已知钛元素在钛铁矿中呈最高价;钛元素最高价氧化物不与H2在高温下反应,却能溶于浓碱中.回答下列问题:
(1)计算钛铁矿样品中氧元素的质量分数;
(2)写出钛铁矿与H2发生反应的化学方程式;
查看习题详情和答案>>为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为(填选项符号):
A.用氢氧化钠溶液润洗仪器并加入氢氧化钠溶液
B.放出氢氧化钠溶液进行滴定
C.调节起始读数
D.查漏,再水洗2-3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视 ;
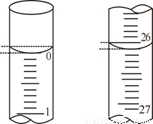
(3)若滴定开始和结束时,碱式滴定管中的液面如上图所示:则所用NaOH溶液的体积为 mL。
(4)某学生根据三次实验分别记录有关数据如下表:
|
滴定次数 |
待测盐酸的体积/mL |
0.1000 mol/LNaOH溶液的体积/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
|
第一次 |
25.00 |
2.00 |
28.15 |
26.15 |
|
第二次 |
25.00 |
1.50 |
29.50 |
28.00 |
|
第三次 |
25.00 |
0.20 |
26.55 |
26.35 |
请选用其中合理的数据计算该洗厕精中酸(盐酸)的物质的量浓度:
c(HCl)= 。
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:(填“偏大”、“偏小” 或“无影响”)
A.若取待测液时,开始仰视读数, 后俯视读数,则 ;
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则 。
查看习题详情和答案>>
为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为(填选项符号):
A.用氢氧化钠溶液润洗仪器并加入氢氧化钠溶液
B.放出氢氧化钠溶液进行滴定
C.调节起始读数
D.查漏,再水洗2-3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视 ;
(3)若滴定开始和结束时,碱式滴定管中的液面如上图所示:则所用NaOH溶液的体积为 mL。
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测盐酸的体积/mL | 0.1000 mol/LNaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 2.00 | 28.15 | 26.15 |
| 第二次 | 25.00 | 1.50 | 29.50 | 28.00 |
| 第三次 | 25.00 | 0.20 | 26.55 | 26.35 |
请选用其中合理的数据计算该洗厕精中酸(盐酸)的物质的量浓度:
c(HCl)= 。
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:(填“偏大”、“偏小” 或“无影响”)
A.若取待测液时,开始仰视读数, 后俯视读数,则 ;
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则 。 查看习题详情和答案>>
(1)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是 。
②大烧杯上如不盖硬纸板,求得的中和热数值将________ (填“ 偏大”“偏小”或“无影响”)。
(2)酸碱中和滴定是中学化学常见实验。
某学校化学课外小组用0.2000 mol·L-1盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
①滴定过程中,眼睛应注视 。
②在铁架台上垫一张白纸,其目的是 。
③根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1。(保留四位有效数字)
④下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果_______。
(1)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是 。
②大烧杯上如不盖硬纸板,求得的中和热数值将________ (填“ 偏大”“偏小”或“无影响”)。
(2)酸碱中和滴定是中学化学常见实验。
某学校化学课外小组用0.2000 mol·L-1盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
①滴定过程中,眼睛应注视 。
②在铁架台上垫一张白纸,其目的是 。
③根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1。(保留四位有效数字)

④下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果_______。
查看习题详情和答案>>