题目内容
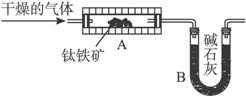
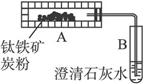
为测定月球上钛铁矿的组成,称取1.53g样品,在高温下通入足量的H2还原,并最终收集到0.180g水.将反应后残渣加入足量浓氢氧化钠溶液中,充分溶解后过滤,将所得滤渣洗涤、烘干后称量得0.570g;将滤渣的一半溶于过量的稀硝酸,并过滤除去0.0100g不溶物后配制成50.0mL溶液;向其一半溶液中加入少许KSCN溶液,显红色;余下的25.0mL溶液中如果加入过量NaOH稀溶液,则生成红褐色沉淀,将沉淀过滤洗涤、灼烧后得0.200g固体.已知钛元素在钛铁矿中呈最高价;钛元素最高价氧化物不与H2在高温下反应,却能溶于浓碱中.回答下列问题:
(1)计算钛铁矿样品中氧元素的质量分数;
(2)写出钛铁矿与H2发生反应的化学方程式;
答案:
解析:
解析:
|
(1)31.4% (2)FeTiO3+H2 (3)不仅是铁、钛、氧元素的主要资源,而且FeTiO3与H2反应将是人类建立月球基地获取水资源的重要途径. |

练习册系列答案
相关题目
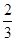 。
。
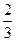 。
。
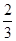 。
。