网址:http://m.1010jiajiao.com/timu_id_174446[举报]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
C
A
B
B
D
C
B
C
A
AB
AD
C
BD
AD
15.(14分)(1)66.7%(2分), 46.7%(2分),
6 (NH2)2CO → C3H6N6 + 6 NH3 + 3 CO2(2分)
②C3H6N6+3H2O=C3N3(OH)3+3NH3
(2) ①N2H4+H2O NH2NH3+(N2H5+)+OH- (2分)
NH2NH3+(N2H5+)+OH- (2分)
(NH2NH3++
H2O NH3NH32++OH- )
NH3NH32++OH- )
② CO(NH2)2+ NaClO+ 2NaOH = N2H4+NaCl+Na2CO3 +H2O (2分)
③N2H4(l)+O2(l)=N2(g)+2H2O(l) ΔH=-621.23 kJ?mol-1 (2分)
16.(10分)(1)量筒 22.80 (2分)
(2)①,0.6(1分)酚酞(1分)② 无色溶液变成浅红色,且半分钟内不褪色(2分)
③c(NaOH)= (2分)
(2分)
④B(2分)
17. ⑴Na+[ ]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2O Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
18. (1)Al
(2)① C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
② NO CO2
(3)Cu2+ Fe3+ H+
(4)2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
(5)CuO、C; CuO、C、Fe2O3
19. ⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I― == 2Fe2+ + I2
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1 3
20.(1)吸热(2)1/9,1/7(3)2NO+O2+4CO=4CO2+N2
21.(12分)(1) 0.75mol/L (3分)
(2)Na2CO3,NaOH ;(3分) 1:3 。(3分)
(3) 112 mL。(3分)
(10分)(1)、火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量的热。 已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式 。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中单键与双键的数目之比为 。
(3)结构和组成相似的原子晶体、离子晶体或金属晶体,一般而言,其熔沸点的高低与其相对分子质量的大小无关,主要是由构成晶体的原子或离子的 决定,其值越小,熔沸点往往越高。
查看习题详情和答案>>
(10分)(1)、火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量的热。 已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式 。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中单键与双键的数目之比为 。
(3)结构和组成相似的原子晶体、离子晶体或金属晶体,一般而言,其熔沸点的高低与其相对分子质量的大小无关,主要是由构成晶体的原子或离子的 决定,其值越小,熔沸点往往越高。
查看习题详情和答案>>
通常状况下,过氧化氢是一种无色透明的液体,在实验室和生产中应用广泛.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642.2 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1
H2O(l)=H2O(g) △H=44 kJ·mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l)的热化学方程式:________.
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为________.
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如下图所示,再加热水解即可得H2O2和(NH4)2SO4.

①电解时,阳极的电极方程式________;
②写出生成H2O2的反应的化学方程式:
________.
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如下图所示.
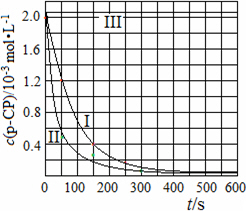
①请根据实验I的曲线,计算降解反应在50~150 s内的反应速率ν(p-CP)=________mol·L-1·s-1.
②实验I、II表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:________.
③实验III得出的结论是:pH=10时,________.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642.2kJ?mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1
H2O(l)=H2O(g)△H=44kJ?mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l) 的热化学方程式:
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含 H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如图1所示,再加热水解即可得H2O2和(NH4)2SO4.
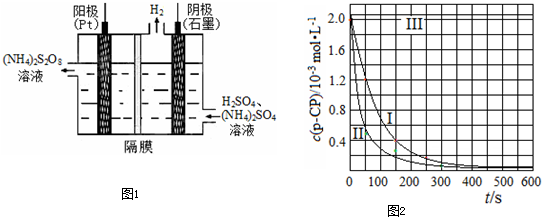
①电解时,阳极的电极方程式
②写出生成H2O2的反应的化学方程式:
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如图2所示.
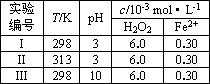
| 实验 编号 |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| Ⅰ | 298 | 3 | 6.0 | 0.30 |
| Ⅱ | 313 | 3 | 6.0 | 0.30 |
| Ⅲ | 298 | 10 | 6.0 | 0.30 |
在50~150s内的反应速率ν(p-CP)=
②实验Ⅰ、Ⅱ表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:
③实验Ⅲ得出的结论是:pH=10时,