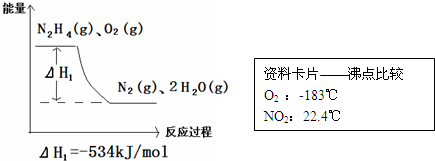
题目内容
(10分)(1)、火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量的热。 已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式 。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中单键与双键的数目之比为 。
(3)结构和组成相似的原子晶体、离子晶体或金属晶体,一般而言,其熔沸点的高低与其相对分子质量的大小无关,主要是由构成晶体的原子或离子的 决定,其值越小,熔沸点往往越高。
解析:

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目