题目内容
通常状况下,过氧化氢是一种无色透明的液体,在实验室和生产中应用广泛.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642.2 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1
H2O(l)=H2O(g) △H=44 kJ·mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l)的热化学方程式:________.
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为________.
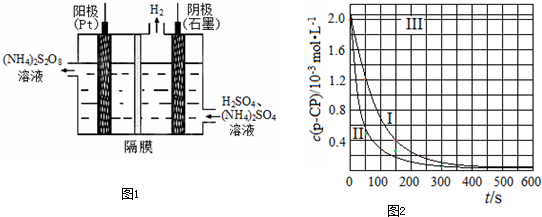
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如下图所示,再加热水解即可得H2O2和(NH4)2SO4.
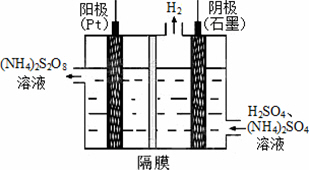
①电解时,阳极的电极方程式________;
②写出生成H2O2的反应的化学方程式:
________.
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如下图所示.

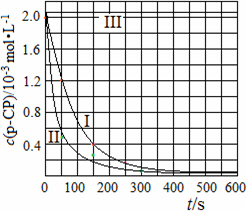
①请根据实验I的曲线,计算降解反应在50~150 s内的反应速率ν(p-CP)=________mol·L-1·s-1.
②实验I、II表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:________.
③实验III得出的结论是:pH=10时,________.
解析:
(1)N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-621.8 kJ·mol-1(2分)
(2)H2O2![]() HO2-=H+(2分)
HO2-=H+(2分)
(3)①2SO42--2e-=S2O82-(2分)
②(NH4)2S2O8+2H2O![]() H2O2+(NH4)2SO4+2H2SO4(2分)
H2O2+(NH4)2SO4+2H2SO4(2分)
(4)①8.0×10-6(2分)
②过氧化氢在温度过高时迅速分解(2分)
③反应速率趋向于零(或该降解反应趋于停止,或其他合理答案)(2分)

 名校通行证有效作业系列答案
名校通行证有效作业系列答案