摘要:(2) NaHCO3.Na2CO3 . 1:1 . 0.112L .
网址:http://m.1010jiajiao.com/timu_id_174319[举报]
碳酸钠和碳酸氢钠是重要的工业原料.某学生活动小组为探究它们的性质并测定某天然碱的成分进行了下述实验.
Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)
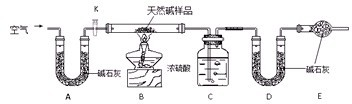
Ⅱ.某天然碱的组成为aNa2CO3?bNaHCO3?cH2O(a、b、c为正整数).现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为7.3g.实验时忽略装置内空气中的CO2和水蒸气.
请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明
(2)NaHCO3受热分解的化学方程式为
(3)E处碱石灰的作用
(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是
查看习题详情和答案>>

Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
;向上述溶液中滴入过量CaCl2溶液,观察到的现象是产生白色沉淀,且溶液红色褪去
产生白色沉淀,且溶液红色褪去
.Ⅱ.某天然碱的组成为aNa2CO3?bNaHCO3?cH2O(a、b、c为正整数).现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为7.3g.实验时忽略装置内空气中的CO2和水蒸气.
请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明
样品重于砝码
样品重于砝码
;(2)NaHCO3受热分解的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
;
| ||
(3)E处碱石灰的作用
防止空气中的CO2和水蒸气进入U型管D中
防止空气中的CO2和水蒸气进入U型管D中
;(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是
使反应产生的CO2和水蒸气被充分吸收
使反应产生的CO2和水蒸气被充分吸收
.除去下列溶液中的杂质(括号内),写出选用的试剂及反应的离子方程式.
(1)NaCl(Na2CO3) 试剂
(2)NaHCO3(Na2CO3) 试剂
(3)FeSO4(CuSO4) 试剂
查看习题详情和答案>>
(1)NaCl(Na2CO3) 试剂
HCl溶液
HCl溶液
,离子方程式CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
.(2)NaHCO3(Na2CO3) 试剂
CO2
CO2
,离子方程式H2O+CO2+CO32-=2HCaCO3-
H2O+CO2+CO32-=2HCaCO3-
.(3)FeSO4(CuSO4) 试剂
Fe粉
Fe粉
,离子方程式Fe+Cu2+=Fe2++Cu
Fe+Cu2+=Fe2++Cu
.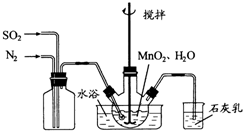 (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:(1)制备MnSO4溶液:
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
①石灰乳参与反应的化学方程式为
SO2+Ca(OH)2=CaSO3+H2O
SO2+Ca(OH)2=CaSO3+H2O
.②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有
控制适当的温度
控制适当的温度
、缓慢通入混合气体
缓慢通入混合气体
.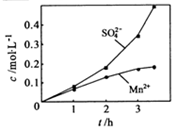
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
Mn2+催化氧气与亚硫酸反应生成硫酸
Mn2+催化氧气与亚硫酸反应生成硫酸
.(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7.请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①
边搅拌边加入碳酸钠或碳酸氢钠,并控制溶液的PH<7.7
边搅拌边加入碳酸钠或碳酸氢钠,并控制溶液的PH<7.7
;②过滤,用水洗涤2-3次
过滤,用水洗涤2-3次
;③检验SO42-是否被除去
检验SO42-是否被除去
;④用少量的乙醇洗涤
用少量的乙醇洗涤
;⑤低于100℃干燥.原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口,将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
(1)两支试管均产生大量气体,投入
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲同学写出了下列热化学方程式(其中“aq”的含义是表示水溶液):HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H>0 CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)△H<0
甲下结论的方法是否正确
请你帮助填写相关内容:
该研究报告的题目可拟为《
通过上述实验可得出四条结论:
①NaHCO3的溶解是
②Na2CO3的溶解是
③NaHCO3的饱和溶液和盐酸的反应是
④Na2CO3的饱和溶液和盐酸的反应是
查看习题详情和答案>>
(1)两支试管均产生大量气体,投入
NaHCO3
NaHCO3
的试管中气体产生较快,投入NaHCO3
NaHCO3
的试管中气球变得更大(以上均填化学式).(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲同学写出了下列热化学方程式(其中“aq”的含义是表示水溶液):HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H>0 CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)△H<0
甲下结论的方法是否正确
不正确
不正确
(填“正确”或“不正确”);为研究是吸热还是放热反应,乙同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
该研究报告的题目可拟为《
NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究(或相关内容)
NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究(或相关内容)
》通过上述实验可得出四条结论:
①NaHCO3的溶解是
吸热
吸热
(填“吸热”或“放热”)过程;②Na2CO3的溶解是
放热
放热
(填“吸热”或“放热”)过程;③NaHCO3的饱和溶液和盐酸的反应是
吸热
吸热
(填“吸热”或“放热”)反应;④Na2CO3的饱和溶液和盐酸的反应是
放热
放热
(填“吸热”或“放热”)反应.