题目内容
碳酸钠和碳酸氢钠是重要的工业原料.某学生活动小组为探究它们的性质并测定某天然碱的成分进行了下述实验.
Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)
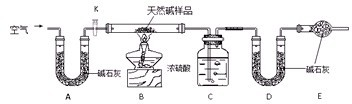
Ⅱ.某天然碱的组成为aNa2CO3?bNaHCO3?cH2O(a、b、c为正整数).现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为7.3g.实验时忽略装置内空气中的CO2和水蒸气.
请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明
(2)NaHCO3受热分解的化学方程式为
(3)E处碱石灰的作用
(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是

Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
;向上述溶液中滴入过量CaCl2溶液,观察到的现象是产生白色沉淀,且溶液红色褪去
产生白色沉淀,且溶液红色褪去
.Ⅱ.某天然碱的组成为aNa2CO3?bNaHCO3?cH2O(a、b、c为正整数).现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为7.3g.实验时忽略装置内空气中的CO2和水蒸气.
请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明
样品重于砝码
样品重于砝码
;(2)NaHCO3受热分解的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
;
| ||
(3)E处碱石灰的作用
防止空气中的CO2和水蒸气进入U型管D中
防止空气中的CO2和水蒸气进入U型管D中
;(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是
使反应产生的CO2和水蒸气被充分吸收
使反应产生的CO2和水蒸气被充分吸收
.分析:Ⅰ.Na2CO3为强碱弱酸盐,溶液中碳酸根离子水解导致溶液显示碱性;加入氯化钡溶液,碳酸根离子与钡离子反应生成碳酸钡沉淀;
Ⅱ.(1)根据天平称量时左物右码原则判断天平指针向左偏转原因;
(2)根据碳酸氢钠加入分解生成二氧化碳、碳酸钠和水写出反应的化学方程式;
(3)本实验是通过测定生成二氧化碳的质量测定碳酸氢钠的质量,所以需要避免空气中的水分和二氧化碳的干扰;
(4)装置B、C中都存有二氧化碳,反应停止后打开活塞K,缓缓鼓入空气数分钟,将碳酸氢钠分解生成的二氧化碳完全进入装置D.
Ⅱ.(1)根据天平称量时左物右码原则判断天平指针向左偏转原因;
(2)根据碳酸氢钠加入分解生成二氧化碳、碳酸钠和水写出反应的化学方程式;
(3)本实验是通过测定生成二氧化碳的质量测定碳酸氢钠的质量,所以需要避免空气中的水分和二氧化碳的干扰;
(4)装置B、C中都存有二氧化碳,反应停止后打开活塞K,缓缓鼓入空气数分钟,将碳酸氢钠分解生成的二氧化碳完全进入装置D.
解答:解:Ⅰ.Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-;若在该溶液中滴加过量的BaCl2溶液,当加入BaCl2后,Ba2++CO32-═BaCO3↓,由于c(CO32-)减小,水解平衡左移,c(OH-)也随之减小,酚酞的红色慢慢消失,
故答案为:CO32-+H2O?HCO3-+OH-; 产生白色沉淀,且溶液红色褪去;
Ⅱ.(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明托盘天平的左盘中的样品质量大于砝码质量,
故答案为:样品重于砝码;
(2)碳酸氢钠加热容易分解,反应的化学方程式为:2NaHCO3
Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
(3)实验的目的是通过测定碱石灰的质量变化测定二氧化碳的质量,从而确定碳酸氢钠的质量,因此必须防止空气中的二氧化碳和水分对实验产生干扰,所以在D碱石灰后面添加E,防止空气中的CO2和水蒸气进入U型管D中,
故答案为:防止空气中的CO2和水蒸气进入U型管D中;
(4)试题是通过测定装置D中质量差测定生成二氧化碳的质量,然后确定碳酸氢钠的质量,所以必须保证碳酸氢钠分解产生的二氧化碳尽可能被装置D吸收,因此在反应停止后打开活塞K,缓缓鼓入空气数分钟,使反应产生的CO2和水蒸气被充分吸收,
故答案为:使反应产生的CO2和水蒸气被充分吸收.
故答案为:CO32-+H2O?HCO3-+OH-; 产生白色沉淀,且溶液红色褪去;
Ⅱ.(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明托盘天平的左盘中的样品质量大于砝码质量,
故答案为:样品重于砝码;
(2)碳酸氢钠加热容易分解,反应的化学方程式为:2NaHCO3
| ||
故答案为:2NaHCO3
| ||
(3)实验的目的是通过测定碱石灰的质量变化测定二氧化碳的质量,从而确定碳酸氢钠的质量,因此必须防止空气中的二氧化碳和水分对实验产生干扰,所以在D碱石灰后面添加E,防止空气中的CO2和水蒸气进入U型管D中,
故答案为:防止空气中的CO2和水蒸气进入U型管D中;
(4)试题是通过测定装置D中质量差测定生成二氧化碳的质量,然后确定碳酸氢钠的质量,所以必须保证碳酸氢钠分解产生的二氧化碳尽可能被装置D吸收,因此在反应停止后打开活塞K,缓缓鼓入空气数分钟,使反应产生的CO2和水蒸气被充分吸收,
故答案为:使反应产生的CO2和水蒸气被充分吸收.
点评:本题综合考查碳酸氢钠和碳酸氢钠的性质、盐类水解的原理等知识,题目难度不大,在学习中要把握盐类水解的原理、应用,能从平衡移动的角度进行判断,注意掌握碳酸钠、碳酸氢钠的性质,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
碳酸钠、碳酸氢钠是两种重要的化学试剂.根据要求回答:
Ⅰ.兴趣小组设计三种方案,鉴别浓度均为0.01mol?L-1碳酸钠和碳酸氢钠两种溶液:
(1)甲方案中pH较大的是 ;
(2)结果表明方案乙无法实现鉴别目的,用离子方程式表示方案乙发生的反应: ; .
(3)经过查阅资料获得如下信息:Ksp(CaCO3)=4.96×10-9;0.01mol?L-1 NaHCO3、Na2CO3溶液中
c(CO32-)如表所示:
丙方案能否实现鉴别目的? ;理由是 ;
Ⅱ.纯碱生产过程中,所得产品往往混有一定量的氯化钠.为检测纯碱的纯度,可采用多种方案来进行.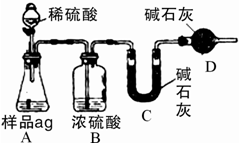
(4)如图为学生丁设计的方案,试图通过测定样品(a g)与足量的稀硫酸反应产生的CO2质量来实现目的.
①本方案存在缺陷,对纯碱纯度检测的影响.
缺陷: ;所测纯碱的纯度将 (填“偏大”或“偏小”).
②方案经改进后,丁进行了实验,并测得B、C、D三套装置的质量分别增重了m1、m2和m3.则纯碱的纯度为 .
(5)现只有少量(约1g)纯碱样品、0.100mol?L-1硫酸和蒸馏水,同学戊拟通过测定一定质量的纯碱样品与硫酸反应时消耗硫酸体积来确定纯碱的纯度.实验过程中,需用 (填仪器名称)测量硫酸的体积,而且实验过程中还需用到的一种试剂是 .
Ⅰ.兴趣小组设计三种方案,鉴别浓度均为0.01mol?L-1碳酸钠和碳酸氢钠两种溶液:
| 序号 | 甲 | 乙 | 丙 |
| 方案 | 用广泛pH试纸 检测溶液pH |
滴加等体积0.1mol?L-1 Ba(OH)2溶液 |
滴加等体积0.1mol?L-1 CaCl2溶液 |
(2)结果表明方案乙无法实现鉴别目的,用离子方程式表示方案乙发生的反应:
(3)经过查阅资料获得如下信息:Ksp(CaCO3)=4.96×10-9;0.01mol?L-1 NaHCO3、Na2CO3溶液中
c(CO32-)如表所示:
| 0.01mol?L-1溶液 | NaHCO3 | Na2CO3 |
| c(CO32-)/mol?L-1 | 0.00011 | 0.0087 |
Ⅱ.纯碱生产过程中,所得产品往往混有一定量的氯化钠.为检测纯碱的纯度,可采用多种方案来进行.

(4)如图为学生丁设计的方案,试图通过测定样品(a g)与足量的稀硫酸反应产生的CO2质量来实现目的.
①本方案存在缺陷,对纯碱纯度检测的影响.
缺陷:
②方案经改进后,丁进行了实验,并测得B、C、D三套装置的质量分别增重了m1、m2和m3.则纯碱的纯度为
(5)现只有少量(约1g)纯碱样品、0.100mol?L-1硫酸和蒸馏水,同学戊拟通过测定一定质量的纯碱样品与硫酸反应时消耗硫酸体积来确定纯碱的纯度.实验过程中,需用