网址:http://m.1010jiajiao.com/timu_id_17264[举报]
I、已知H2A在水中存在以下平衡:H2A
 H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。(1)NaHA溶液的pH______(填大于、小于或等于) Na2A溶液的pH。
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是_____________。
a.c(H+)·c(OH-)=1×10-14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)
 Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。①降低温度时,Ksp______ (填“增大”、“减小”或“不变”)。
②滴加少量浓盐酸,c(Ca2+) ____________(填“增大”、“减小”或“不变”)。
II、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol/L的Cr2O72-。为使废水能达标排放,作如下处理:
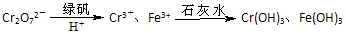
(5)欲使10L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入_______g FeSO4·7H2O。
(6)若处理后的废水中残留的c(Fe3+)=2×10-13mol/L,则残留的Cr3+的浓度为____________。(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液的pH________(填大于、小于或等于)Na2A溶液的pH.
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是________.
a.c(H+)·c(OH-)=1×10-14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0.
Ca2+(aq)+A2-(aq) ΔH>0.
①降低温度时,Ksp________(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)________(填“增大”、“减小”或“不变”).
Ⅱ、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-.为使废水能达标排放,作如下处理:
Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(1)该废水中加入绿矾和H+,发生反应的离子方程式为:________.
(2)欲使10L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O.
(3)若处理后的废水中残留的c(Fe3+)=2×10-13mol·L-1,则残留的Cr3+的浓度为________.(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
(1)电解饱和食盐水的化学方程式为________.
(2)
常温下,某化学兴趣小组在实验室中,用石墨电极以下图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2.24 L.(设电解前后溶液的体积均为1 L,不考虑水的消耗或气体的溶解)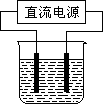
①
理论上,电解后溶液中c(OH-)=________mol/L.②若实际测得反应后溶液的
c(OH-)=0.1 mol/L,则造成这种误差的原因可能是:a.
可能为________(用离子方程式表示).b.2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
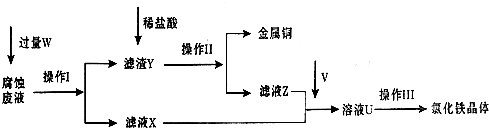
(1)请写出FeCl3溶液与铜反应的离子方程式:
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol?L-1 的浓盐酸配制250mL 1mol?L-1 的稀盐酸,并进行有关实验.
①需要量取浓盐酸
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式:
| ||
| ||
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀.该过程中调节溶液的pH为5,则金属离子浓度为
(12分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
I、已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
⑴NaHA溶液的pH (填大于、小于或等于) Na2A溶液的pH。
⑵某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 。
a.c(H+)·c(OH-)=1×10―14 b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol/L
⑶已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低温度时,Ksp (填“增大”、“减小”或“不变”)。
②滴加少量浓盐酸,c(Ca2+) (填“增大”、“减小”或“不变”)。
II、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,作如下处理:
(1)该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为: 。
(2)欲使10L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入 g FeSO4·7H2O。
(3)若处理后的废水中残留的c(Fe3+)=2×10-13mol·L-1,则残留的Cr3+的浓度为 。(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)