摘要:(1)写出:A的电子式 .J的结构式 .M的化学式 .(2)基于反应①原理的化学工业称为 .写出该反应的化学方程式 .(3)写出K和E反应的离子方程式 .写出F溶液和H反应的离子方程式 .(4)已知由G分解得到的H.I.J三者的物质的量相等.则G的化学式为 .
网址:http://m.1010jiajiao.com/timu_id_170088[举报]
 五、19、(10分)(1)
(2分)
五、19、(10分)(1)
(2分)
(2)Na+ (2分)
(3)由于HF中含有以氢键相结合的聚合氟化氢分子(HF)n (3分),(其它合理答案参考给分)
(4)Na3AlF6 (3分)
20、(10分) (1) 减小 (2分) (2) 1 (2分)
(3) 正确(1分) 2 molX和1 molY不可能完全反应 (1分)
(4) A (2分,有错不给分)
(5)  (2分)
(2分)
六、21、(10分)(1)H+ + OH― = H2O, CO32― + H+ = HCO3― (4分)
(2)224mL(2分)
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
 x + y = 1mol/L×(0.045-0.025)L
x + y = 1mol/L×(0.045-0.025)L
z - y = 1mol/L×[0.025-(0.045-0.025)]L
x=0.01mol,y=0.01mol,z=0.015mol
所以,NaOH的质量为:0.015mol
*
等电子体的结构相似,物理性质相近,该原理常被用于发现或者合成具有特殊功能的晶体和有机物等诸多领域。X是一种新型的无机材料,它与碳化硅(SiC)的结构相似,物理性质相近,符合该原理。X有如下的转变
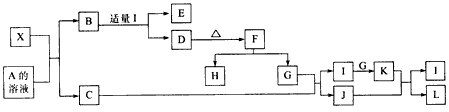
其中C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且既溶于强酸又溶于强碱溶液;E溶液的焰色反应呈黄色。
回答以下问题:
(1)写出X的化学式:_______________。
(2)写出X与A溶液反应的化学方程式:_____________写出K与J反应的化学方程式_____________。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(横线上填新物质的化学式):
_______+2N2 4X+SiC+3C。
4X+SiC+3C。
查看习题详情和答案>>
回答以下问题:
(1)写出X的化学式:_______________。
(2)写出X与A溶液反应的化学方程式:_____________写出K与J反应的化学方程式_____________。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(横线上填新物质的化学式):
_______+2N2
 4X+SiC+3C。
4X+SiC+3C。 下表为长式周期表的一部分,其中的编号代表对应的元素.
试填空.
(1)写出上表中元素D形成单质的电子式为
 ;
;
(2)元素K基态原子的电子排布式
 ;元素D原子核外的电子占有的轨道数目为
;元素D原子核外的电子占有的轨道数目为
(3)元素M位于周期表的第
(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
(6)A、C、D 形成的ACD分子中,含有
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:

查看习题详情和答案>>
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |
(1)写出上表中元素D形成单质的电子式为


(2)元素K基态原子的电子排布式
[Ar]3d54s1
[Ar]3d54s1
;H元素的离子结构示意图

5
5
个.(3)元素M位于周期表的第
ⅤⅢ
ⅤⅢ
族;当将M单质与酸性KMnO4溶液作用时,1个M原子失去3个电子,这些电子分别是在4s、3d
4s、3d
轨道上的;(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
Mg>Al>Na
Mg>Al>Na
(填对应的元素符号);三种元素最高价氧化物对应水化物的碱性由强到弱排列NaOH>Mg(OH)2>Al(OH)3
NaOH>Mg(OH)2>Al(OH)3
(填对应的化学式).(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
NH4Cl
NH4Cl
,其形成的晶体中含有的化学键类型为离子键和共价键、配位键
离子键和共价键、配位键
.(写出化学键最具体的类别)(6)A、C、D 形成的ACD分子中,含有
2
2
个σ键,2
2
个π键.(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
Mg2+<Na+<F-<O2-
Mg2+<Na+<F-<O2-
(填对应的离子符号)(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
Na2BeO2
Na2BeO2
.(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:
2:3
2:3
.两种晶胞中实际含有原子个数之比为1:2
1:2
.
 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
[Ar]3d74s2
[Ar]3d74s2
.(2)c、d原子半径大小c
>
>
d,第一电离能大小关系是c>
>
d,电负性大小关系是c<
<
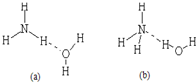
d.(以上填“>”或“<”)(3)已知NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
(b)
(b)
(填序号,见图).(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ?mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
Mg
Mg
、Al
Al
(填写元素符号).如图为元素周期表的一部分,回答下列问题: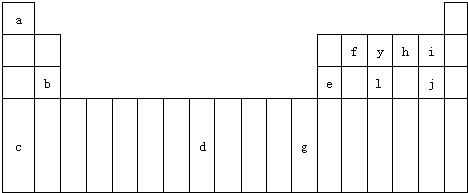
(1)请写出上述元素d基态原子的核外电子排布式
(2)请比较b、e两种元素的第一电离能大的是
(3)i与j的氢化物比较,沸点较高的是
(4)f2a2分子的结构简式是
(5)利用VSEPR理论确定y与a形成的10电子分子的理想构型是
查看习题详情和答案>>

(1)请写出上述元素d基态原子的核外电子排布式
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
;(2)请比较b、e两种元素的第一电离能大的是
Mg
Mg
(写元素符号),其原因是3s2全满稳定
3s2全满稳定
;(3)i与j的氢化物比较,沸点较高的是
HF
HF
(填分子式),原因是HF分子间存在氢键
HF分子间存在氢键
;(4)f2a2分子的结构简式是
CH≡CH
CH≡CH
,元素f为sp
sp
杂化,该分子中σ键和π键的数目比为3:2
3:2
;(5)利用VSEPR理论确定y与a形成的10电子分子的理想构型是
正四面体构型
正四面体构型
,实际构型是三角锥形
三角锥形
.如图是元素周期表的一部分,表中所列字母分别代表一种化学元素:
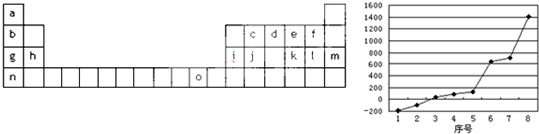
试回答下列问题:
(1)按电子排布,可把周期表中的元素划分成5个区,其中j位于 区.
(2)请写出字母o代表的元素的基态原子外围电子排布式 .
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号).
(4)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶体类型与晶体j相同.两者相比熔点更高的是 (填化学式),试从结构角度加以解释: .
(5)COCl2俗称光气,分子中C原子采取 杂化方式成键;分子中的共价键含有 (填标号).
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1个π键
(6)已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2]分子的空间构型是 .若A在水中溶解度较大,B在CCl4中溶解度较大,试画出A分子的几何构型图 .
查看习题详情和答案>>

试回答下列问题:
(1)按电子排布,可把周期表中的元素划分成5个区,其中j位于
(2)请写出字母o代表的元素的基态原子外围电子排布式
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表
(4)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶体类型与晶体j相同.两者相比熔点更高的是
(5)COCl2俗称光气,分子中C原子采取
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1个π键
(6)已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2]分子的空间构型是