摘要:O2 , 氢氧化铁, Cl- .AlO2-,2Na2O2 + 2 H2O ==4NaOH + O2 ↑,
网址:http://m.1010jiajiao.com/timu_id_168115[举报]
 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍.写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:
O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.铁锈的主要成分是Fe2O3?xH2O
Fe2O3?xH2O
(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(2)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O
| ||
| 充电 |
①此装置中爱迪生蓄电池的负极是
a
a
(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是氧化反应
氧化反应
.②写出在用电解法制取高铁酸钠时,阳极的电极反应式
Fe-6e-+8OH-=FeO42-+4H2O
Fe-6e-+8OH-=FeO42-+4H2O
.③你认为高铁酸钠作为一种新型净水剂的理由可能是
BC
BC
.A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质.
铁是生活和生产中用途最为广泛的金属.请回答下列有关问题:
(1)钢铁在潮湿空气中发生吸氧腐蚀而生锈,正极的电极反应式为
(2)硫酸铁可作絮凝剂,常用于净水,其原理是
(3)氯化铁溶液常用作印刷电路铜板的腐蚀剂,其原理是
(4)下表中对陈述 I、II的正确性及其有无因果关系的判断都正确的是
查看习题详情和答案>>
(1)钢铁在潮湿空气中发生吸氧腐蚀而生锈,正极的电极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.(2)硫酸铁可作絮凝剂,常用于净水,其原理是
Fe3++3H2O
Fe(OH)3(胶体)+3H+
| ||
Fe3++3H2O
Fe(OH)3(胶体)+3H+
(用离子方程式表示).在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
| ||
在酸性条件下抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使废水中的悬浮物沉降除去
在酸性条件下抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使废水中的悬浮物沉降除去
.(3)氯化铁溶液常用作印刷电路铜板的腐蚀剂,其原理是
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
(用离子方程式表示).(4)下表中对陈述 I、II的正确性及其有无因果关系的判断都正确的是
B
B
(填写字母).| 选项 | 陈述 I | 陈述 II | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对,II对,有 |
| B | 常温下铁与稀硫酸反应产生氢气 | 加热条件下氢气能还原氧化铁生成金属铁 | I对,II对,无 |
| C | 铁属于过渡金属 | 铁和铁的某些化合物可以用作催化剂 | I错,II对,无 |
| D | 铁在空气中表面易生成致密氧化膜 | 可以用铁罐储运浓硫酸和浓硝酸 | I对,II对,有 |
(2013?通州区二模)四种短周期元素A、B、C、D的性质或结构信息如下:
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)B元素在周期表中的位置
(2)BC2分子的电子式
 ;
;
(3)A元素的单质与物质甲发生反应的离子方程式
(4)丙的钠盐溶液呈
(5)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色;
②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间;
③试管底部出现红褐色沉淀.向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.
请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字.
①
②
③
查看习题详情和答案>>
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)B元素在周期表中的位置
第2周期ⅣA族
第2周期ⅣA族
;(2)BC2分子的电子式


(3)A元素的单质与物质甲发生反应的离子方程式
Cl2+H2O?H++Cl-+HClO
Cl2+H2O?H++Cl-+HClO
;(4)丙的钠盐溶液呈
碱
碱
性,用化学用语表示其原因Cl-+H2O?HClO+OH-
Cl-+H2O?HClO+OH-
;(5)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色;
②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间;
③试管底部出现红褐色沉淀.向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.
请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字.
①
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色)
浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色)
;②
2H2O2=2H2O+O2↑
2H2O2=2H2O+O2↑
;过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
;③
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
.反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁)
反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁)
.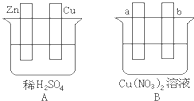 Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜.回答有关问题.
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜.回答有关问题.(1)导线将容器A和B连接时,Zn接
a
a
,Cu接b
b
(填“a”或“b”)(2)容器A中Cu极发生的电极反应为
2H++2e-=H2↑
2H++2e-=H2↑
.(3)B装置叫
电解池
电解池
,溶液中的NO3-向b
b
极移动(填“a”或“b”).(4)若b极观察到有无色无味气泡产生,经过一段时间后,停止反应并搅拌均匀,溶液的pH值将
降低
降低
(填“升高”、“降低”或“不变”),加入一定量的CuO
CuO
后(填化学式),溶液能恢复至与反应前完全一致.若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是:B装置是电镀池
B装置是电镀池
.Ⅱ.炒菜的铁锅没有洗干净容易生锈.用必要的文字和有关化学方程式说明铁锈是如何形成的
铁、碳和氯化钠溶液构成原电池,铁作负极而被腐蚀,碳作正极,正极上氧气得电子生成氢氧根离子,氢氧根离子和亚铁离子反应生成氢氧化亚铁,氢氧化亚铁不稳定易被氧化生成氢氧化铁,氢氧化铁失水生成铁锈,反应方程式为:2Fe+O2+2H2O=2Fe(OH)2,4Fe(OH)2+2H2O+O2=4Fe(OH)3
铁、碳和氯化钠溶液构成原电池,铁作负极而被腐蚀,碳作正极,正极上氧气得电子生成氢氧根离子,氢氧根离子和亚铁离子反应生成氢氧化亚铁,氢氧化亚铁不稳定易被氧化生成氢氧化铁,氢氧化铁失水生成铁锈,反应方程式为:2Fe+O2+2H2O=2Fe(OH)2,4Fe(OH)2+2H2O+O2=4Fe(OH)3
.下列对应化学反应的离子方程式中正确的是( )
| A、用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)?Fe(OH)3↓+3H+ | B、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- | C、用惰性电极电解CuSO4溶液:2Cu2++2H2O?4H++O2↑+2Cu | D、用食醋除去水瓶中的水垢(主要成分为碳酸钙):CaCO3+2H+?Ca2++CO2↑+H2O |