摘要:(3)设计如下实验探究硫和含硫化合物的相互转化:(Ⅰ)完成下列各个反应的化学方程式 ①A中在加热时发生的反应 ②C中的反应 (Ⅱ)记录观察到的实验现象 ①B中品红试液由红色变为 .加热后又 .(结论:可以根据该现象用品红试液来证明SO2的存在与否).②D 中没有观察到什么现象.在实验结束后往D中滴加H2O2后则可以看到 .③E 中溶液现象是: 而在该反应中SO2是 剂.(Ⅲ)G的作用是吸收尾气.写出反应的离子方程式 (Ⅳ)F溶液在放置一段时间后.其pH变小的理由.是因为: 五.计算题(6分)
网址:http://m.1010jiajiao.com/timu_id_168106[举报]
(2011?厦门一模)某化学兴趣小组用如图装置模拟工业制备造纸原料BaSO3,并测定产品纯度.
(1)图1烧瓶中发生反应的化学方程式为
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有①BaSO3、②
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
实验二:测定产品纯度
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入
×100%
×100%(用含m、w的式子表示).本测定方案有缺陷,请指出本方案的缺点及其对实验结果的可能影响.
答:
(5)为制备纯净的BaSO3,请设计改进图1装置的实验方案.
答:
查看习题详情和答案>>

(1)图1烧瓶中发生反应的化学方程式为
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
; (2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有①BaSO3、②
BaSO4
BaSO4
;实验一:探究白色沉淀的成分
(3)设计如下实验方案:
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量 稀盐酸 稀盐酸 ,充分振荡. |
若 沉淀部分溶解 沉淀部分溶解 ,则含有②. |
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入
稀硫酸
稀硫酸
(可从稀盐酸、稀硝酸、稀NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为| 217m |
| 64w |
| 217m |
| 64w |
答:
选用盐酸溶解沉淀,因为盐酸挥发出氯化氢气体被C吸收后可以导致结果偏大;二氧化硫未被完全吸收可能导致结果偏小
选用盐酸溶解沉淀,因为盐酸挥发出氯化氢气体被C吸收后可以导致结果偏大;二氧化硫未被完全吸收可能导致结果偏小
;(5)为制备纯净的BaSO3,请设计改进图1装置的实验方案.
答:
先从烧瓶的左边通入氮气排除这种中的空气
先从烧瓶的左边通入氮气排除这种中的空气
.(2012?虹口区二模)某实验兴趣小组为了测定镀锌铁皮中锌的质量分数ω(Zn),设计如下实验方案.
【方案甲】测定试样与6mol/L盐酸溶液反应前后固体的质量变化,流程如下:

(1)操作II中镀层反应完的标志是
(2)操作III中,检验铁片已洗净的方法是
(3)若要进一步计算锌镀层厚度,还需知道的物理量是:镀锌铁皮的表面积S、
【方案乙】测定试样与6mol/L的烧碱溶液反应生成的氢气体积,装置如图:

[已知:锌易溶于强碱溶液:Zn+2NaOH+2H2O→Na2Zn(OH)4+H2↑]
(4)配制250mL 6mol/L的NaOH溶液,需要量取48%的浓NaOH溶液(密度为1.506g/cm3)
(5)为精确测定H2体积,在反应结束并冷却后,用针筒在储液瓶左侧乳胶管处进行抽气,直至
(6)已知镀锌铁皮的质量为m g,加入烧碱溶液的体积为V1mL(所有体积数据均已折算至标准状况,下同),最终液体量瓶中水的体积为V2mL,针筒抽出气体的体积为V3mL.选择合理数据,计算ω(Zn)=
×100%
×100%.
查看习题详情和答案>>
【方案甲】测定试样与6mol/L盐酸溶液反应前后固体的质量变化,流程如下:

(1)操作II中镀层反应完的标志是
生成氢气的速率突然减慢
生成氢气的速率突然减慢
.操作IV的名称是烘干
烘干
.(2)操作III中,检验铁片已洗净的方法是
取最后一次洗涤液,加入硝酸银溶液,无白色沉淀产生,则铁片已洗净
取最后一次洗涤液,加入硝酸银溶液,无白色沉淀产生,则铁片已洗净
.(3)若要进一步计算锌镀层厚度,还需知道的物理量是:镀锌铁皮的表面积S、
金属锌的密度
金属锌的密度
.【方案乙】测定试样与6mol/L的烧碱溶液反应生成的氢气体积,装置如图:

[已知:锌易溶于强碱溶液:Zn+2NaOH+2H2O→Na2Zn(OH)4+H2↑]
(4)配制250mL 6mol/L的NaOH溶液,需要量取48%的浓NaOH溶液(密度为1.506g/cm3)
83
83
mL,用规格为100
100
mL量筒量取.(5)为精确测定H2体积,在反应结束并冷却后,用针筒在储液瓶左侧乳胶管处进行抽气,直至
储液瓶中导管内外液面相平
储液瓶中导管内外液面相平
为止.若省略此步骤,测得的体积数据将偏小
偏小
(填“偏大”、“偏小”或“不变”).(6)已知镀锌铁皮的质量为m g,加入烧碱溶液的体积为V1mL(所有体积数据均已折算至标准状况,下同),最终液体量瓶中水的体积为V2mL,针筒抽出气体的体积为V3mL.选择合理数据,计算ω(Zn)=
| 65×(V2+V3)×10-3 |
| 22.4×m |
| 65×(V2+V3)×10-3 |
| 22.4×m |
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
×100%
×100%.
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
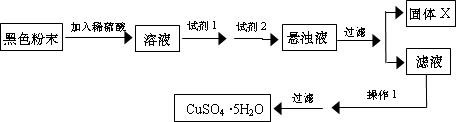
试回答:
①试剂I为
②固体X的化学式为
③操作I为
查看习题详情和答案>>
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
溶液变为血红色
溶液变为血红色
.(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
不合理
不合理
简述你的理由(不需写出反应的方程式 )Cu能将Fe3+还原为Fe2+
Cu能将Fe3+还原为Fe2+
.(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
Fe2O3和Cu2O的混合物
Fe2O3和Cu2O的混合物
,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+
Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+
.探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:

试回答:
①试剂I为
B
B
,试剂II为D
D
(填字母).②固体X的化学式为
Fe(OH)3
Fe(OH)3
.③操作I为
加热蒸发
加热蒸发
.(2009?清远模拟)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料
Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
×100%
×100%.
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4.5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
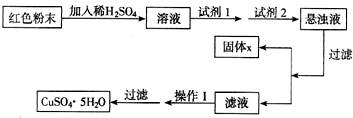
试回答:
试剂1为
查看习题详情和答案>>
查阅资料
Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
没有红色不溶物,滴加KSCN溶液,溶液变为红色
没有红色不溶物,滴加KSCN溶液,溶液变为红色
.(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
不合理
不合理
.简述你的理由(可不写反应的方程式 )Cu能将Fe3+还原为Fe2+
Cu能将Fe3+还原为Fe2+
.(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
Fe2O3和Cu2O的混合物
Fe2O3和Cu2O的混合物
,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
.探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4.5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:

试回答:
试剂1为
B
B
,试剂2为D
D
(填字母序号);固体x的化学式是Fe(OH)3
Fe(OH)3
.某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置.

(1)写出仪器①的名称:
(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.
该反应中的还原剂是
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未退色.请你分析产生该现象的原因
查看习题详情和答案>>

(1)写出仪器①的名称:
酒精灯
酒精灯
.(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓)
| ||
该反应中的还原剂是
HCl
HCl
(填化学式),若有6mol的HCl参加反应,则转移的电子总数为3NA
3NA
;(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是
品红溶液褪色
品红溶液褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B
褪色的品红恢复红色
褪色的品红恢复红色
,D无明显现象
无明显现象
.(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未退色.请你分析产生该现象的原因
Cl2+SO2+2H2O=2HCl+H2SO4
Cl2+SO2+2H2O=2HCl+H2SO4
(用化学方程式表示).