题目内容
(2011?厦门一模)某化学兴趣小组用如图装置模拟工业制备造纸原料BaSO3,并测定产品纯度.
(1)图1烧瓶中发生反应的化学方程式为
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有①BaSO3、②
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
实验二:测定产品纯度
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入
×100%
×100%(用含m、w的式子表示).本测定方案有缺陷,请指出本方案的缺点及其对实验结果的可能影响.
答:
(5)为制备纯净的BaSO3,请设计改进图1装置的实验方案.
答:

(1)图1烧瓶中发生反应的化学方程式为
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
; (2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有①BaSO3、②
BaSO4
BaSO4
;实验一:探究白色沉淀的成分
(3)设计如下实验方案:
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量 稀盐酸 稀盐酸 ,充分振荡. |
若 沉淀部分溶解 沉淀部分溶解 ,则含有②. |
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入
稀硫酸
稀硫酸
(可从稀盐酸、稀硝酸、稀NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为| 217m |
| 64w |
| 217m |
| 64w |
答:
选用盐酸溶解沉淀,因为盐酸挥发出氯化氢气体被C吸收后可以导致结果偏大;二氧化硫未被完全吸收可能导致结果偏小
选用盐酸溶解沉淀,因为盐酸挥发出氯化氢气体被C吸收后可以导致结果偏大;二氧化硫未被完全吸收可能导致结果偏小
;(5)为制备纯净的BaSO3,请设计改进图1装置的实验方案.
答:
先从烧瓶的左边通入氮气排除这种中的空气
先从烧瓶的左边通入氮气排除这种中的空气
.分析:(1)亚硫酸钠和浓硫酸反应生成二氧化硫气体、硫酸钠和水;
(2)可能二氧化硫被氧化为三氧化硫在溶液中形成硫酸,所以白色沉淀可能是硫酸钡;
(3)硫酸钡和亚硫酸钡都不溶于水,加入盐酸,亚硫酸钡沉淀可以溶解,硫酸钡不溶于盐酸;
(4)装置2是利用白色沉淀加入酸溶解生成的二氧化硫气体干燥后被碱石灰吸收来测定二氧化硫的质量,酸溶解亚硫酸钡沉淀,所以氢氧化钠不符合,盐酸易挥发出氯化氢气体,干扰测定结果,应选用稀硫酸;C装置增重为二氧化硫的质量,依据元素守恒计算亚硫酸钡的质量得到质量分数;
缺陷是若选用盐酸溶解沉淀会导致测定结果偏大;装置中生成的二氧化硫气体不能全部被碱石灰吸收会导致结果偏小;
(5)图1装置中烧瓶改用三孔塞,其中利用导气管通入惰气如氮气,把装置中的空气全部赶到出.
(2)可能二氧化硫被氧化为三氧化硫在溶液中形成硫酸,所以白色沉淀可能是硫酸钡;
(3)硫酸钡和亚硫酸钡都不溶于水,加入盐酸,亚硫酸钡沉淀可以溶解,硫酸钡不溶于盐酸;
(4)装置2是利用白色沉淀加入酸溶解生成的二氧化硫气体干燥后被碱石灰吸收来测定二氧化硫的质量,酸溶解亚硫酸钡沉淀,所以氢氧化钠不符合,盐酸易挥发出氯化氢气体,干扰测定结果,应选用稀硫酸;C装置增重为二氧化硫的质量,依据元素守恒计算亚硫酸钡的质量得到质量分数;
缺陷是若选用盐酸溶解沉淀会导致测定结果偏大;装置中生成的二氧化硫气体不能全部被碱石灰吸收会导致结果偏小;
(5)图1装置中烧瓶改用三孔塞,其中利用导气管通入惰气如氮气,把装置中的空气全部赶到出.
解答:解:(1)亚硫酸钠和浓硫酸反应生成二氧化硫气体、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O,
故答案为;Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O;
(2)可能二氧化硫被氧化为三氧化硫在溶液中形成硫酸,所以白色沉淀可能是亚硫酸钡和硫酸钡.
故答案为:BaSO4;
(3)用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液,白色沉淀不溶解,溶液呈红色,说明硫酸钡和亚硫酸钡都不溶于水,加入盐酸,亚硫酸钡沉淀可以溶解,硫酸钡不溶于盐酸,沉淀部分溶解证明含有硫酸钡沉淀,
故答案为:稀盐酸;沉淀部分溶解;
(4)装置2是利用白色沉淀加入酸溶解生成的二氧化硫气体干燥后被碱石灰吸收来测定二氧化硫的质量,酸溶解亚硫酸钡沉淀,所以氢氧化钠不符合,盐酸易挥发出氯化氢气体,干扰测定结果,应选用稀硫酸;C装置增重为二氧化硫的质量,依据元素守恒计算亚硫酸钡的质量=
×217g/mol,得到亚硫酸钡质量分数=
×100%=
×100%;
缺陷是若选用盐酸溶解沉淀会导致测定结果偏大;装置中生成的二氧化硫气体不能全部被碱石灰吸收会导致结果偏小,
故答案为:稀硫酸;
×100%;若选用盐酸溶解沉淀会导致测定结果偏大;装置中生成的二氧化硫气体不能全部被碱石灰吸收会导致结果偏小;
(5)图1装置中烧瓶改用三孔塞,其中利用导气管通入惰气如氮气,先从烧瓶的左边通入氮气排除装置中的空气,减少测定误差,
故答案为:先从烧瓶的左边通入氮气排除装置中的空气.
故答案为;Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O;
(2)可能二氧化硫被氧化为三氧化硫在溶液中形成硫酸,所以白色沉淀可能是亚硫酸钡和硫酸钡.
故答案为:BaSO4;
(3)用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液,白色沉淀不溶解,溶液呈红色,说明硫酸钡和亚硫酸钡都不溶于水,加入盐酸,亚硫酸钡沉淀可以溶解,硫酸钡不溶于盐酸,沉淀部分溶解证明含有硫酸钡沉淀,
故答案为:稀盐酸;沉淀部分溶解;
(4)装置2是利用白色沉淀加入酸溶解生成的二氧化硫气体干燥后被碱石灰吸收来测定二氧化硫的质量,酸溶解亚硫酸钡沉淀,所以氢氧化钠不符合,盐酸易挥发出氯化氢气体,干扰测定结果,应选用稀硫酸;C装置增重为二氧化硫的质量,依据元素守恒计算亚硫酸钡的质量=
| mg |
| 64g/mol |
| ||
| W |
| 217m |
| 64w |
缺陷是若选用盐酸溶解沉淀会导致测定结果偏大;装置中生成的二氧化硫气体不能全部被碱石灰吸收会导致结果偏小,
故答案为:稀硫酸;
| 217m |
| 64w |
(5)图1装置中烧瓶改用三孔塞,其中利用导气管通入惰气如氮气,先从烧瓶的左边通入氮气排除装置中的空气,减少测定误差,
故答案为:先从烧瓶的左边通入氮气排除装置中的空气.
点评:本题考查了物质组成和性质的实验探究和验证,实验分析,现象判断,实验设计是解题关键,题目难度中等.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
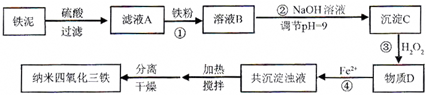
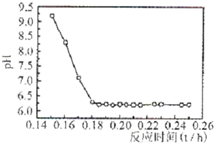
 (2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答
(2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答