题目内容
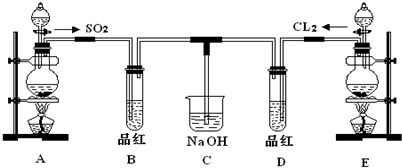
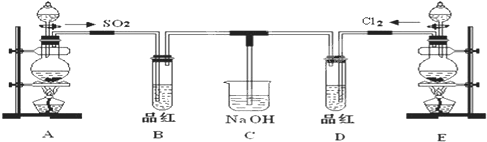
某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置.

(1)写出仪器①的名称:
(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.
该反应中的还原剂是
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未退色.请你分析产生该现象的原因

(1)写出仪器①的名称:
酒精灯
酒精灯
.(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓)
| ||
该反应中的还原剂是
HCl
HCl
(填化学式),若有6mol的HCl参加反应,则转移的电子总数为3NA
3NA
;(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是
品红溶液褪色
品红溶液褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B
褪色的品红恢复红色
褪色的品红恢复红色
,D无明显现象
无明显现象
.(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未退色.请你分析产生该现象的原因
Cl2+SO2+2H2O=2HCl+H2SO4
Cl2+SO2+2H2O=2HCl+H2SO4
(用化学方程式表示).分析:(1)根据装置图分析;
(2)MnO2和浓盐酸反应二氧化锰作氧化剂,HCl作还原剂,根据化合价的变化判断电子转移;
(3)①氯气和二氧化硫都能使品红溶液褪色;
②二氧化硫漂白后的物质具有不稳定性,而氯气的漂白具有不可逆性;
(4)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl.
(2)MnO2和浓盐酸反应二氧化锰作氧化剂,HCl作还原剂,根据化合价的变化判断电子转移;
(3)①氯气和二氧化硫都能使品红溶液褪色;
②二氧化硫漂白后的物质具有不稳定性,而氯气的漂白具有不可逆性;
(4)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl.
解答:解:(1)根据装置图分析可知,仪器①为酒精灯,故答案为:酒精灯;
(2)MnO2和浓盐酸反应二氧化锰作氧化剂,HCl作还原剂;HCl→
Cl2失去1mol电子,方程式中4molHCl中有2mol被氧化,所以6mol的HCl参加反应时,有3molHCl被氧化,则转移3mol电子,所以转移的电子总数为3NA;
故答案为:HCl;3NA;
(3)①氯气和二氧化硫都具有漂白性,都能是品红溶液褪色,故答案为:品红溶液褪色;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,加热也不能恢复红色,
故答案为:褪色的品红恢复红色;无明显现象;
(4)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生Cl2+SO2+2H2O=2HCl+H2SO4,不再具有漂白性,
故答案为Cl2+SO2+2H2O=2HCl+H2SO4.
(2)MnO2和浓盐酸反应二氧化锰作氧化剂,HCl作还原剂;HCl→
| 1 |
| 2 |
故答案为:HCl;3NA;
(3)①氯气和二氧化硫都具有漂白性,都能是品红溶液褪色,故答案为:品红溶液褪色;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,加热也不能恢复红色,
故答案为:褪色的品红恢复红色;无明显现象;
(4)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生Cl2+SO2+2H2O=2HCl+H2SO4,不再具有漂白性,
故答案为Cl2+SO2+2H2O=2HCl+H2SO4.
点评:本题考查氯气和二氧化碳漂白性的对比实验,题目难度中等,本题注意二者的性质的异同,特别是漂白原理的不同.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
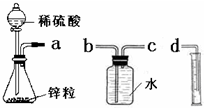 某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.(1)为达到本实验目的其装置连接顺序为:
a连
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸 | 10mL | t1 | v1 |
| 4mol/L硫酸 | 10mL | t2 | v2 |
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
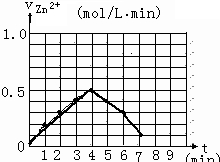
请解释0到4mim时该化学反应速率随时间变化的原因:
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有: