摘要:21.(1)H+.HCO3― CO32―.HCO3―-------------------------------------------4分(2)CO2本身在水中的溶解度小.H+浓度增大.上述电离平衡向左移动放出CO2---3分
网址:http://m.1010jiajiao.com/timu_id_161466[举报]
(2011?广东模拟)为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:
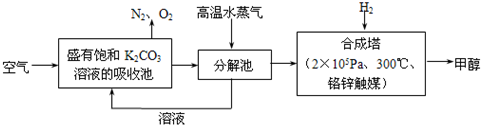
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式是
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳.该电池负极发生的反应是:
CH3OH+H2O-6e-═CO2+6H+
则正极发生的反应是
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K=
(4)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9.小李应该选用的试剂是
查看习题详情和答案>>

(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式是
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol
.(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳.该电池负极发生的反应是:
CH3OH+H2O-6e-═CO2+6H+
则正极发生的反应是
O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
;放电时,H+移向电池的正
正
(填“正”或“负”)极.(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K=
4.2×10-7mol?L-1
4.2×10-7mol?L-1
.(已知:10-5.6=2.5×10-6)(4)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)
>
>
c(CO32-) (填“>”、“=”或“<”),原因是溶液存在平衡HCO3-?CO32-+H+、HCO3-+H2O?H2CO3+OH-,而HCO3-的水解程度大于电离程度
溶液存在平衡HCO3-?CO32-+H+、HCO3-+H2O?H2CO3+OH-,而HCO3-的水解程度大于电离程度
(用离子方程式和必要的文字说明).(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9.小李应该选用的试剂是
Ba(OH)2(或NaOH溶液和BaCl2溶液)
Ba(OH)2(或NaOH溶液和BaCl2溶液)
.A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).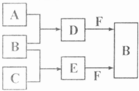 试回答:
试回答:
(1)E的电子式是
 .
.
(2)单质X和B或D均能反应生成黑色磁性固体Y,Y的化学式是
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等.Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是
(4)取0.3mol F与足量D充分混合后,所得溶液中再通入0.2mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)
(5)E的大量排放会引发很多环境问题.有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用.25℃,101kPa时,该反应的热化学方程式是
查看习题详情和答案>>
 试回答:
试回答:(1)E的电子式是


(2)单质X和B或D均能反应生成黑色磁性固体Y,Y的化学式是
Fe3O4
Fe3O4
.(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等.Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是
O3+2H++2I-=O2+I2+H2O
O3+2H++2I-=O2+I2+H2O
.(4)取0.3mol F与足量D充分混合后,所得溶液中再通入0.2mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
.(5)E的大量排放会引发很多环境问题.有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用.25℃,101kPa时,该反应的热化学方程式是
CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol
CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol
.(已知甲醇的燃烧热△H=-726.5kJ?mol-1,氢气的燃烧热△H=-285.8kJ?mol-1)Ⅰ.已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是
(2)写出H2CO3电离方程式是
(3)写出下列反应的化学方程式:足量的氢氟酸与碳酸钠溶液混合:
Ⅱ.氨水中存在:NH3?H2O?NH4++OH-,在5份0.01mol?L-1的氨水中分别加入下列各物质:
A.浓氨水 B.纯水 C.少量NaOH固体 D.少量浓硫酸 E.NH4Cl固体
按照要求填空:
(1)电离平衡会向正向移动是
(2)c(NH4+)、c(OH-)都增大的是
(3)c(NH4+)增大,c(OH-)减小的是
查看习题详情和答案>>
| ① | HF | Ka=6.8×10-4 mol?L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol?L-1 |
| ③ | HCN | Ka=6.2×10-10 mol?L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol?L-1 Ka2=4.7×10-11 mol?L-1 |
(1)四种酸中酸性最强的是
HF
HF
,四种酸中酸性最弱的是HCN
HCN
.(2)写出H2CO3电离方程式是
H2CO3?HCO3-+H+
H2CO3?HCO3-+H+
、HCO3-?CO32-+H+
HCO3-?CO32-+H+
.(3)写出下列反应的化学方程式:足量的氢氟酸与碳酸钠溶液混合:
2HF+Na2CO3═2NaF+H2O+CO2↑
2HF+Na2CO3═2NaF+H2O+CO2↑
;足量的CO2通入NaCN溶液中:NaCN+H2O+CO2═HCN+NaHCO3
NaCN+H2O+CO2═HCN+NaHCO3
.Ⅱ.氨水中存在:NH3?H2O?NH4++OH-,在5份0.01mol?L-1的氨水中分别加入下列各物质:
A.浓氨水 B.纯水 C.少量NaOH固体 D.少量浓硫酸 E.NH4Cl固体
按照要求填空:
(1)电离平衡会向正向移动是
ABD
ABD
;电离平衡会向逆向移动是CE
CE
.(2)c(NH4+)、c(OH-)都增大的是
A
A
;c(NH4+)、c(OH-)都较小的是B
B
.(3)c(NH4+)增大,c(OH-)减小的是
E
E
;c(NH4+)减小,c(OH-)增大的是C
C
.有A、B、C、D、E五种无色溶液,它们是硝酸钙、稀盐酸、硝酸银、碳酸钠和氯化钡.各取少量进行两两混合实验,结果如下(表中“↓”表示有沉淀出现,“↑”表示有气体生成,“-”表示没有明显现象):
(1)请写出A、B、C、D、E各溶液中溶质的化学式:
A
(2)请写出A+B,C+D,D+E反应的离子方程式
①A+B:
②C+D:
③A+D:
查看习题详情和答案>>
| A | B | C | D | E | |
| A | ↓ | - | ↓ | - | |
| B | ↓ | ↓ | - | ||
| C | - | ↓ | ↑ | - | |
| D | ↓ | ↓ | ↑ | ↓ | |
| E | - | - | - | ↓ |
A
BaCl2
BaCl2
BAgNO3
AgNO3
CHCl
HCl
DNa2CO3
Na2CO3
ECa(NO3)2
Ca(NO3)2
(2)请写出A+B,C+D,D+E反应的离子方程式
①A+B:
Cl-+Ag+=AgNO3↓
Cl-+Ag+=AgNO3↓
;②C+D:
2H++CO32-=H2O+CO2↑或H++CO32-=HCO3-
2H++CO32-=H2O+CO2↑或H++CO32-=HCO3-
;③A+D:
Ca2++CO32-=CaCO3↓
Ca2++CO32-=CaCO3↓
.