摘要:A.0.1mol?L―1氨水中.c(OH―)=c(NH+4)
网址:http://m.1010jiajiao.com/timu_id_161423[举报]
下列关系的表述中,正确的是( )
| A、0.1mol?L-1的Na2CO3溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | B、0.1mol?L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | C、中和pH和体积都相同的硫酸和醋酸,消耗NaOH的物质的量相同 | D、pH=4的盐酸和pH=4的FeCl3溶液中,水电离的c(H+)不相等 |
(2010?青岛二模)(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:
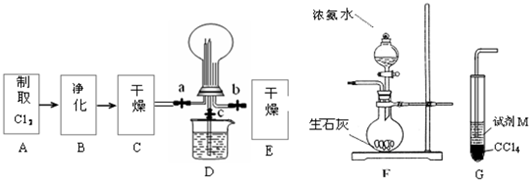
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管).请回答A中发生反应的离子方程式
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:

①从下列试剂中选择试剂x为
A.0.1mol?L-1KMnO4(H2SO4酸化)溶液
B.0.5mol?L-11NaOH溶液
C.新制氯水
D.KI溶液
②加入试剂x生成SO42-的离子方程式为
③第ⅲ步的“系列操作”包含的操作名称为
④证明该废水中是否含有CO32-的实验方案为
查看习题详情和答案>>

①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管).请回答A中发生反应的离子方程式
MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O
| ||
MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O
,试剂M为
| ||
FeI2
FeI2
溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色;
先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色;
;②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为
黄绿色气体消失,产生白烟,
黄绿色气体消失,产生白烟,
,反应一段时间后,关闭b打开c,观察到的现象为烧杯中的液体进入烧瓶中,形成喷泉
烧杯中的液体进入烧瓶中,形成喷泉
;③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法
将F装置中分液漏斗顶端的塞子打开,再打开分液漏斗的旋塞,使分液漏斗中的液体
流下.
流下.
将F装置中分液漏斗顶端的塞子打开,再打开分液漏斗的旋塞,使分液漏斗中的液体
流下.
;流下.
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:

①从下列试剂中选择试剂x为
C
C
(填序号):A.0.1mol?L-1KMnO4(H2SO4酸化)溶液
B.0.5mol?L-11NaOH溶液
C.新制氯水
D.KI溶液
②加入试剂x生成SO42-的离子方程式为
Cl2+SO32-+H2O=2Cl-+SO42-+2H+;
Cl2+SO32-+H2O=2Cl-+SO42-+2H+;
;③第ⅲ步的“系列操作”包含的操作名称为
过滤
过滤
、洗涤
洗涤
、干燥
干燥
;④证明该废水中是否含有CO32-的实验方案为
向废水中加入足量的盐酸,将生成的气体先通入足量的酸性KMnO4溶液,再通入澄清石灰水,若紫色KMnO4溶液颜色变浅,石灰水变浑浊,则证明废水中含有CO32-
向废水中加入足量的盐酸,将生成的气体先通入足量的酸性KMnO4溶液,再通入澄清石灰水,若紫色KMnO4溶液颜色变浅,石灰水变浑浊,则证明废水中含有CO32-
.物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学的知识回答:
(1)A为0.1mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
(2)B为0.1mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),在25℃时,氯化银的Ksp=1.8×10-10.现将足量氯化银分别放入:
①100mL蒸馏水中;②100mL 0.2mol/L AgNO3溶液中;③100mL 0.1mol/L氯化铝溶液中;④100mL 0.1mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
(5)E为CuSO4溶液,已知25℃时,Ksp[Cu(OH)2]=2×10-20.要使0.2mol?L-1 E溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
查看习题详情和答案>>
(1)A为0.1mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
.(2)B为0.1mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:
HCO
的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性
- 3 |
HCO
的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性
.- 3 |
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入
盐酸
盐酸
溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为Fe3++3HCO
═Fe(OH)3↓+3CO2↑
- 3 |
Fe3++3HCO
═Fe(OH)3↓+3CO2↑
.- 3 |
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),在25℃时,氯化银的Ksp=1.8×10-10.现将足量氯化银分别放入:
①100mL蒸馏水中;②100mL 0.2mol/L AgNO3溶液中;③100mL 0.1mol/L氯化铝溶液中;④100mL 0.1mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
)②>①>④>③
)②>①>④>③
(填写序号);②中氯离子的浓度为9×10-10
9×10-10
mol/L.(5)E为CuSO4溶液,已知25℃时,Ksp[Cu(OH)2]=2×10-20.要使0.2mol?L-1 E溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
6
6
.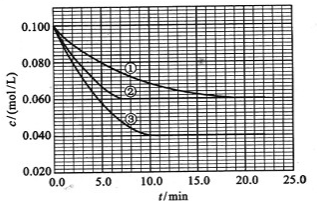 (2013?潍坊模拟)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.1mol/L,c(B)=0.2mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
(2013?潍坊模拟)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.1mol/L,c(B)=0.2mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:
②
加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
;③
温度升高;达到平衡的时间缩短,平衡时A的浓度减小
温度升高;达到平衡的时间缩短,平衡时A的浓度减小
;(2)实验②平衡时B的转化率为
40%(或0.4)
40%(或0.4)
;实验③平衡时C的浓度为0.06mol/L
0.06mol/L
;(3)该反应为
吸热
吸热
(填“吸热”或“放热”)反应,判断其理由是升高温度向正方向移动,故该反应是吸热反应
升高温度向正方向移动,故该反应是吸热反应
;(4)该反应进行到4.0min时的平均反应速度率:
实验②:vB=
0.014mol(L?min)-1
0.014mol(L?min)-1
,实验③:vC=0.008mol(L?min)-1
0.008mol(L?min)-1
.