题目内容
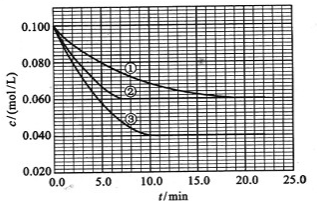 (2013?潍坊模拟)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.1mol/L,c(B)=0.2mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
(2013?潍坊模拟)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.1mol/L,c(B)=0.2mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:
②
加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
;③
温度升高;达到平衡的时间缩短,平衡时A的浓度减小
温度升高;达到平衡的时间缩短,平衡时A的浓度减小
;(2)实验②平衡时B的转化率为
40%(或0.4)
40%(或0.4)
;实验③平衡时C的浓度为0.06mol/L
0.06mol/L
;(3)该反应为
吸热
吸热
(填“吸热”或“放热”)反应,判断其理由是升高温度向正方向移动,故该反应是吸热反应
升高温度向正方向移动,故该反应是吸热反应
;(4)该反应进行到4.0min时的平均反应速度率:
实验②:vB=
0.014mol(L?min)-1
0.014mol(L?min)-1
,实验③:vC=0.008mol(L?min)-1
0.008mol(L?min)-1
.分析:(1)根据催化剂对化学反应速度率和化学平衡的影响;根据温度对化学反应速度率和化学平衡的影响,在溶液中,压强对化学平衡无影响;
(2)根据转化率的概念计算;根据平衡三部曲进行计算;
(3)根据温度对化学平衡的影响;
(4)根据化学反应速率的公式以及反应速率之比等于化学计量数之比进行计算;
(2)根据转化率的概念计算;根据平衡三部曲进行计算;
(3)根据温度对化学平衡的影响;
(4)根据化学反应速率的公式以及反应速率之比等于化学计量数之比进行计算;
解答:解:(1)因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂;因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,故答案为:②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;③温度升高;达到平衡的时间缩短,平衡时A的浓度减小;
(2)实验②平衡时B的转化率为
×100%=40%;
根据 A+2B?C
初始 (mol/L) 0.1 0.2 0
转化 (mol/L) 0.06 0.12 0.06
平衡(mol/L) 0.04 0.08 0.06
平衡时C的浓度为0.06mol/L,
故答案:40%;0.06mol/L;
(3)因③温度升高,化学平衡向吸热的方向移动,平衡时A的浓度减小,说明正反应方向吸热,故答案为:吸热;升高温度向正方向移动,故该反应是吸热反应.
(4)因vA=△C/△t=
=0.007mol(L?min)-1,所以vB=2vA=0.014mol(L?min)-1;
同理vC=0.008mol(L?min)-1,
故答案为:0.014mol(L?min)-1;0.008mol(L?min)-1.
(2)实验②平衡时B的转化率为
| 0.04 |
| 0.1 |
根据 A+2B?C
初始 (mol/L) 0.1 0.2 0
转化 (mol/L) 0.06 0.12 0.06
平衡(mol/L) 0.04 0.08 0.06
平衡时C的浓度为0.06mol/L,
故答案:40%;0.06mol/L;
(3)因③温度升高,化学平衡向吸热的方向移动,平衡时A的浓度减小,说明正反应方向吸热,故答案为:吸热;升高温度向正方向移动,故该反应是吸热反应.
(4)因vA=△C/△t=
| 0.028mol |
| 4min |
同理vC=0.008mol(L?min)-1,
故答案为:0.014mol(L?min)-1;0.008mol(L?min)-1.
点评:本题考查化学平衡的有关知识和化学计算,本题难度不大,做题时注意平衡三部曲的应用.

练习册系列答案
相关题目
 (2013?潍坊模拟)如图,“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳特别是二氧化碳的排放.下列行为不利于低碳生活的是( )
(2013?潍坊模拟)如图,“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳特别是二氧化碳的排放.下列行为不利于低碳生活的是( ) (2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.