网址:http://m.1010jiajiao.com/timu_id_157397[举报]
一、选择题:
 1、C 2、D 3、C 4、A 5、B 6、C 7、A 8、C 9、A 10、C 11、B
1、C 2、D 3、C 4、A 5、B 6、C 7、A 8、C 9、A 10、C 11、B
12、D 13、A
二、不定向选择题:
14、C 15、B 16、ABC 17、A 18、B 19、C 20、ABC 21、ABC
三必答题:
22、(15分)
(1)3.
(3)①R1 ,(2分) ② 见答图1(2分)③BD(2分)
23、(15分)
(1)由题图可知雪橇开始做加速度逐渐减小的加速运动,最后作匀速直线运动。(3分)
(2)当雪橇的速度为
a=2.
(3)当雪橇的速度为
mgSinθ―μmgCosθ―kv=ma(3分)
当雪橇匀速运动时速度Vm=
mgSinθ=μmgCosθ+kVm(3分)
两式联立解得k=37.5,μ=0.125(2分)
24、解:(1)小球做匀速圆周运动时合力大小一定,方向垂直与速度方向指向圆心,所以重力和电场力平衡,洛仑兹力做向心力,故有
mg=Eq,解得E=mg/q 方向向上(2分)
(2)由平抛运动知识得
 d=VOt (1分) OP=VYt/2 (1分) 又有VY/VO=tan600(1分)
d=VOt (1分) OP=VYt/2 (1分) 又有VY/VO=tan600(1分)
联立解得OP=3d/2(1分)
由圆运动知识得到
BqV=mV2/R (1分)
由题意得
V0/V=Cos600(1分)
 d=2RSin600 (1分) 解得V0=Bqd/2m(1分)
d=2RSin600 (1分) 解得V0=Bqd/2m(1分)
(3)由题意可知带电小球的运动周期应等于从P运动到Q所用时间的两倍与从Q到O的圆运动经历的时间之和
t1= d/V0 (1分) t2=2T0/3 (1分) T0=2πm/Bq(1分)
d/V0 (1分) t2=2T0/3 (1分) T0=2πm/Bq(1分)
解得T=2t1+t2=m(4π/3+2 )/Bq(1分)
)/Bq(1分)
因每个周期发生的位移为 d,所以在足够长的时间内沿X轴方向的平均速度为
d,所以在足够长的时间内沿X轴方向的平均速度为
V= d/T=3
d/T=3 Bq d/(4π+6
Bq d/(4π+6 )(3分)
)(3分)
25.本题共14分,每空2分
(1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分) (2)较低温度(2分)
2NaOH+H2↑+Cl2↑(2分) (2)较低温度(2分)
(3)2Fe3++3ClO―+10OH―=2FeO―4+3Cl―+5H2O(2分) (4)AC(2分)
(5)K2FeO4具有强氧化性(2分); 氢氧化铁胶体(2分) (6)KNO3、KCl(2分)
26.本题共15分
(1)NO2、SO2(2分); 0.3(2分); 3(
(2)SO2+Ca(OH)2=CaSO3↓+H2O(2分)、2CaSO3+O2+4H2O=2CaSO4?2H2O(2分)
(3)①释放(2分) ②32(L/mol/)(3分,没有单位也可)
27.本题共14分
(1)甲方案不易控制通入CO2的量(2分); 乙方案过程繁琐,操作复杂(2分)
(2)将NaOH溶液分为均等的两份(1分),向其中一份通入过量的CO2(1分),然后再与另一份NaOH溶液混合(1分),所得溶液即为纯Na2CO3溶液
(3)CaCl2(或BaCl2等)(2分); 有白色沉淀产生(1分)
(4)能(2分); 固体样品的质量和沉淀的总质量(2分)
28、(15分)回答下列I、II题:
I、(3分)(1)基因重组(杂交育种);(1分)
(2)基因工程或转基因;(1分)
(3)培育出的个体是纯合子,后代不发生性状分离;(1分)
Ⅱ.(12分) ⑴ ①实验前对该组小鼠的活动情况进行观察并记录。 (2分)
②将该组小鼠各注射等量适宜浓度的胰岛素溶液,观察并记录。 (2分)
③―段时间后,当小鼠出现低血糖症状后,给每只小鼠注射等量适宜浓度的葡萄糖
溶液,观察并记录。 (2分)
(2)①注射胰岛素溶液前,小鼠活动正常 (2分)
②注射胰岛素溶液后,小鼠出现低血糖症状 (2分)
③注射葡萄糖溶液后,小鼠的低血糖症状缓解 (2分)
29、(24分)
I、(1)消化酶(或蛋白酶)(2分) 细胞呼吸 (2分) ATP。(2分)
(2)溶酶体 (2分)
(3)核糖体 (2分) 脱水缩合 (2分)
II、【答案】1.实验步骤②中暗室用红色安全灯是错误的.应改为用绿色安全灯(此项若不改,在对照中提到也给分);(2分)
2.实验步骤⑤中的“葡萄糖”是错误的。应改为“淀粉”;(2分)
3.未设对照。对照的做法是:a.装置同题干中的步骤①。但玻璃罩内用同一种生长状况相同的另一株植物代替题干中的植物。用一杯清水代替NaoH溶液.(2分) b.将上述植物及装置放在暗室中饥饿。消耗掉叶片内贮藏的有机物。暗室装有绿色安全灯;(2分) c.重复题干中的步骤③④ (2分) d.重复改正后的题干中的步骤⑤(2分)
四、选答题:
30、【物理-----选修2―2】
(1)(6分)2 :1(3分),3 :2(3分)
(2)(9分)由有固定转动轴物体的平衡条件得
FLSin370=m1gL/2+m2gL +mgL/2(7分)
解得:F=433(N) (2分)
31、(1)(6分)A
(2)(9分)解:①由玻意耳定律得
P0(VA―V)+NP0V0=P(VA―V)
代入数据解得N=18次 (5分)
②由玻意耳定律得
P(VA―V)=P0(VA―V+△V)
代入数据解得△V=
32、(1)(6分)CD
(2)(9分)解:①在B点由折射定律得到Sin600/Sinα=
解得α=300(2分)
在底面上C点由折射定律得到Sinα/Sinβ=1/
解得β=600(2分)
在三角形OCB中OC=BC= R/3(1分)
R/3(1分)
所以d/OC=Cot300 解得d=R/3(1分)
②由于蓝光的折射率大于红光的折射率,因此光线2经半圆柱体两次折射后偏折更大,此时的d将比上述结果小一些。(2分)
33、【物理-----选修3―5】
(1)(6分)B
(2)(9分)解:(1)弹簧将物块和小车弹开的过程中有动量守恒定律得
MV=mv (2分)
物块离开P点后由平抛运动相关知识得
H=gt2/2 (1分)
(v+V)t=L (2分)
三式联立解得物块速度v=3.
(2)弹簧将物块和小车弹开的过程中弹性势能转化为小车和物块的动能,所以有
E=MV2/2+mv2/2=5.6J (3分)
34.本题共15分
(1)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl(2分)
(2)CO2(1分); NH3(1分)
(3)Na2CO3(1分)、NH4Cl(1分); CaCl2(1分)、NaCl(1分)
(4)不需要(1分); CaCO3+2NaCl=Na2CO3+CaCl2(2分)
(5)b(1分)
(6)94.3 %(2分); 不产生无用的CaCl2(或提高了食盐的转化率等等)(1分)
35.本题共15分
(1)1s22s22p3(1分); 氨分子之间有氢键(2分)
(2)sp3(2分); CO2属于分子晶体,SiO2属于原子晶体(2分)
(3)N>O>C(2分)
(4)CH4和NH+4、NH3和H3O+、CO2和N2O、CO和N2(每组1分,共2分)
(5)1∶2(2分); Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态(2分)
36.本题共15分
(1)C4H6O2(2分); CH2=C(CH3)COOH(2分)
(2)
 (2分) (3)2CH3CH2OH+O2
(2分) (3)2CH3CH2OH+O2
 2CH3CHO+2H2O(2分)
2CH3CHO+2H2O(2分)
(4)
 +CH3COOH→
+CH3COOH→
 +H2O(2分);
+H2O(2分);
酯化(或取代)反应(1分)
(5)②(2分) (6)
 (其它合理答案也可)(2分)
(其它合理答案也可)(2分)
37、【生物-----选修1生物技术实践】(15分)
(1)纤维素 (2)B、E (3)纤维素
38、【生物----选修3现代生物科技专题】(15分)
(1)DNA分子杂交(3分) (2)膀胱上皮 (3分)
(3) 细胞核 ; 去核的卵; 核移植(或克隆) (3分)
 火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:
火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:(1)脱硫:用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为生石膏(CaSO4?2H2O).写出上述反应的两个化学方程式:
①在空气中的SO2与碳酸钙悬浊液反应
②在空气中的SO2与熟石灰悬浊液反应
(2)脱氮:氮氧化物进入大气后,可形成硝酸型酸雨和光化学烟雾,必须对其进行处理.
①用过量的NaOH溶液吸收NO2气体,所得的溶液中除了含有NaOH、NaNO2,还含有
②若某时刻烟气排出的尾气中NOx的含量为0.056%(体积分数),用氨气可以将其转化为无害气体,发生的反应为:6NOx+4xNH3=(3+2x)N2+6xH2O,若处理1×105L(标准状况)该尾气需42.5gNH3,则x=
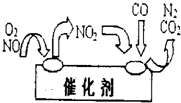
(3)汽车排出的尾气中也含有氮氧化物,为避免污染,常给汽车安装尾气净化装置.净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示.写出净化过程中的总化学反应方程式:
| ||
| ||
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(2)脱碳.将二氧化碳转化为甲醇:CO2+3H2
| 催化剂 | 加热、加压 |
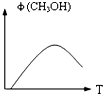 .
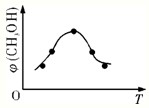
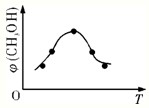
.如图表示某次合成实验中甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线,则上述二氧化碳转化为甲醇反应的△H
(3)脱硫.用碳酸钙作吸收剂与水配制成浆液,在吸收塔中洗涤烟气并吸收SO2,得到石膏(CaSO4?2H2O).
电厂第一季度用煤300t(煤中含有硫2.8%),若燃烧时煤中的硫全部转化成二氧化硫,且吸收脱硫过程中80%的硫转化为转化为石膏,则第一季度可生产石膏
(4)最新处理技术是用纳米型氧缺位铁酸盐(MFe2OX3<x<4,M=Mn、Co等金属)来处理燃煤排烟.常温条件下,纳米型氧缺位铁酸盐能使烟气中的酸性氧化物转化为单质,自身被氧化为MFe2O4.已知:93.2g纳米型氧缺位铁酸锌(ZnFe2OX)能处理含SO2 0.01%的尾气22400L(标准状况),则ZnFe2OX中的x=
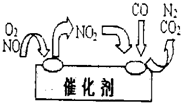 火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:
火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:
(1)脱硫:用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为生石膏(CaSO4?2H2O).写出上述反应的两个化学方程式:
①在空气中的SO2与碳酸钙悬浊液反应______;
②在空气中的SO2与熟石灰悬浊液反应______;
(2)脱氮:氮氧化物进入大气后,可形成硝酸型酸雨和光化学烟雾,必须对其进行处理.
①用过量的NaOH溶液吸收NO2气体,所得的溶液中除了含有NaOH、NaNO2,还含有______.
②若某时刻烟气排出的尾气中NOx的含量为0.056%(体积分数),用氨气可以将其转化为无害气体,发生的反应为:6NOx+4xNH3=(3+2x)N2+6xH2O,若处理1×105L(标准状况)该尾气需42.5gNH3,则x=______.
(3)汽车排出的尾气中也含有氮氧化物,为避免污染,常给汽车安装尾气净化装置.净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示.写出净化过程中的总化学反应方程式:______.
查看习题详情和答案>>
(1)脱硝.利用甲烷催化还原NOx,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H2=-1160kJ?mol-1
在一定条件下,甲烷直接将NO2还原为N2的热化学方程式为:
(2)脱碳.将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);△H3
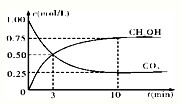
CH3OH(g)+H2O(g);△H3①在1L的密闭容器中,充入1molCO2和3molH2,在一定温度下,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
则0~10min内,H2的平均反应速率为
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述反应的△H3
(3)脱硫.某种脱硫工艺是将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.设燃煤废气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为:
(4)硫酸铵和硝酸铵的水溶液的pH<7,其原因是
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+(1)脱硝.利用甲烷催化还原NOx,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H2=-1160kJ?mol-1
在一定条件下,甲烷直接将NO2还原为N2的热化学方程式为:______.
(2)脱碳.将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)

CH3OH(g)+H2O(g);△H3
①在1L的密闭容器中,充入1molCO2和3molH2,在一定温度下,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
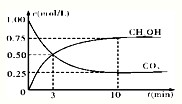
则0~10min内,H2的平均反应速率为______;达到平衡时,CO2的转化率为______;该温度下该反应的 K=______.
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述反应的△H3______0(填“>”、“<”或“=”).
(3)脱硫.某种脱硫工艺是将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.设燃煤废气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为:______.
(4)硫酸铵和硝酸铵的水溶液的pH<7,其原因是______(用离子方程式表示).