题目内容
火力发电厂燃煤排烟,释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体.这些气体直接排放到空气中,将造成环境污染.为解决排烟污染问题,某发电厂采用如下措施,对燃煤烟气进行脱硝、脱硫和脱碳等处理,实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(2)脱碳.将二氧化碳转化为甲醇:CO2+3H2
CH3OH(g)+H2O(g);写出该反应平衡常数K= 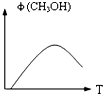 .
.
如图表示某次合成实验中甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线,则上述二氧化碳转化为甲醇反应的△H 0(填>、=、或<).
(3)脱硫.用碳酸钙作吸收剂与水配制成浆液,在吸收塔中洗涤烟气并吸收SO2,得到石膏(CaSO4?2H2O).
电厂第一季度用煤300t(煤中含有硫2.8%),若燃烧时煤中的硫全部转化成二氧化硫,且吸收脱硫过程中80%的硫转化为转化为石膏,则第一季度可生产石膏 吨.
(4)最新处理技术是用纳米型氧缺位铁酸盐(MFe2OX3<x<4,M=Mn、Co等金属)来处理燃煤排烟.常温条件下,纳米型氧缺位铁酸盐能使烟气中的酸性氧化物转化为单质,自身被氧化为MFe2O4.已知:93.2g纳米型氧缺位铁酸锌(ZnFe2OX)能处理含SO2 0.01%的尾气22400L(标准状况),则ZnFe2OX中的x= .
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(2)脱碳.将二氧化碳转化为甲醇:CO2+3H2
| 催化剂 | 加热、加压 |
 .
.如图表示某次合成实验中甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线,则上述二氧化碳转化为甲醇反应的△H
(3)脱硫.用碳酸钙作吸收剂与水配制成浆液,在吸收塔中洗涤烟气并吸收SO2,得到石膏(CaSO4?2H2O).
电厂第一季度用煤300t(煤中含有硫2.8%),若燃烧时煤中的硫全部转化成二氧化硫,且吸收脱硫过程中80%的硫转化为转化为石膏,则第一季度可生产石膏
(4)最新处理技术是用纳米型氧缺位铁酸盐(MFe2OX3<x<4,M=Mn、Co等金属)来处理燃煤排烟.常温条件下,纳米型氧缺位铁酸盐能使烟气中的酸性氧化物转化为单质,自身被氧化为MFe2O4.已知:93.2g纳米型氧缺位铁酸锌(ZnFe2OX)能处理含SO2 0.01%的尾气22400L(标准状况),则ZnFe2OX中的x=
分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积来解答;根据到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
(3)根据关系式S~SO2~CaSO4?2H2O来计算;
(4)利用电子守恒确定Fe元素的化合价,以此确定x.
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积来解答;根据到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
(3)根据关系式S~SO2~CaSO4?2H2O来计算;
(4)利用电子守恒确定Fe元素的化合价,以此确定x.
解答:解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
利用盖斯定律,由
得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(2)将二氧化碳转化为甲醇,该反应平衡常数K=
;由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0;
故答案为:
;<;
(3)S~SO2 ~CaSO4?2H2O
32 172
300t×2.8%×80% m
=
,解得m=36.12t,
故答案为:36.12t;
(4)93.2g纳米型氧缺位铁酸锌的物质的量为
mol,SO2的物质的量为
=0.1mol,1个纳米型氧缺位铁酸锌(ZnFe2OX)失去(3-x+1)个电子,1个SO2得到4个电子,由电子守恒可知,
量为
×2×(3-x+1)=0.1mol×4,解得x=3.5,
故答案为:3.5.
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
利用盖斯定律,由
| ①+② |
| 2 |
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(2)将二氧化碳转化为甲醇,该反应平衡常数K=
| C( H2O)?C(CH3OH) |
| C(CO2)?C3(H2) |
故答案为:
| C( H2O)?C(CH3OH) |
| C(CO2)?C3(H2) |
(3)S~SO2 ~CaSO4?2H2O
32 172
300t×2.8%×80% m
| 32 |
| 300t×2.8%×80% |
| 172 |
| m |
故答案为:36.12t;
(4)93.2g纳米型氧缺位铁酸锌的物质的量为
| 93.2 |
| 177+16X |
| 22400×0.01% |
| 22.4 |
量为
| 93.2 |
| 177+16X |
故答案为:3.5.
点评:本题涉及热化学方程式的书写、平衡常数的概念、平衡状态的判断以及外界条件对平衡移动的影响等问题以及化学计算,在计算时,注意原理的掌握,题目难度中等.

练习册系列答案
相关题目
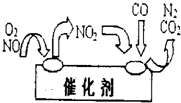 火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:
火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:
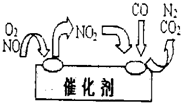 火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:
火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题: