题目内容
下面实验是用于测定茶叶中含有Ca、Al、Fe三种元素的.
已知:草酸铵(NH4)2C2O4属于弱电解质.草酸钙难溶于水,Ca2+、Al3+、Fe3+完全沉淀分别pH:pH≥13;pH≥5.5;pH≥4.1;
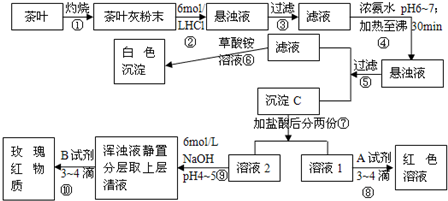
根据上述过程及信息填空.
(1)步骤②加盐酸的作用是______
(2)写出检验Ca2+的离子方程式______
(3)写出沉淀C所含主要物质的化学式______
(4)写出步骤⑧中加入A试剂生成红色溶液的离子方程式______
(5)步骤⑨的作用是______.
已知:草酸铵(NH4)2C2O4属于弱电解质.草酸钙难溶于水,Ca2+、Al3+、Fe3+完全沉淀分别pH:pH≥13;pH≥5.5;pH≥4.1;

根据上述过程及信息填空.
(1)步骤②加盐酸的作用是______
(2)写出检验Ca2+的离子方程式______
(3)写出沉淀C所含主要物质的化学式______
(4)写出步骤⑧中加入A试剂生成红色溶液的离子方程式______
(5)步骤⑨的作用是______.
(1)向茶叶灰分中加盐酸的作用是将其中的Ca2+、Al3+、Fe3+溶解,故答案为:使Ca2+、Al3+、Fe3+等离子溶解;
(2)⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+,
故答案为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
(3)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,
故答案为:Fe(OH)3、Al(OH)3;
(4)步骤⑧是检验Fe3+,可加入KSCN进行检验,溶液变红色,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe3++3SCN-=Fe(SCN)3;
(5)将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全,分离后用玫瑰红物质可检验Al元素的存在,
故答案为:将Fe3+转化为沉淀,并检验Al元素的存在.
(2)⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+,
故答案为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
(3)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,
故答案为:Fe(OH)3、Al(OH)3;
(4)步骤⑧是检验Fe3+,可加入KSCN进行检验,溶液变红色,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe3++3SCN-=Fe(SCN)3;
(5)将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全,分离后用玫瑰红物质可检验Al元素的存在,
故答案为:将Fe3+转化为沉淀,并检验Al元素的存在.

练习册系列答案
相关题目