网址:http://m.1010jiajiao.com/timu_id_14179[举报]
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
A
B
D
B
B
A
A
C
B
C
二、选择题
题号
11
12
13
14
15
答案
A
CD
C
AC
D
三、填空、简答和计算
17.(1) g?mol-1 (2)
g?mol-1 (2)
18.(1)11 mol、10 mol、10 mol;(2)1.204×1023
19.A,A,D,D,
20. 24,40,56
21.据题意有 A + B ==== C + D
16 20 W 4.5
根据质量守恒定律W=16+20-4.5=
A+B====C+D

x=15.75(g)
所以C的摩尔质量为 =
=
22. 设参加反应的锌的物质的量为x, 析出铜的物质的量为y, 生成ZnSO4的物质的量为z.
CuSO4 + Zn = ZnSO4 + Cu 质量增加
1mol 1mol 1mol 1mol
x
z y
解得:x=0.1mol y=0.1mol z=0.1mol
生成ZnSO4的质量:m(ZnSO4)=
答:略。
(1)高温电解技术能高效实现CO2(g) + H2O(g) =CO(g) + H2(g) +O2(g)? ,工作原理示意图如下:

①电极b发生??????? (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是?????????????????????????????? 。
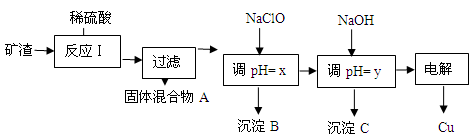
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+? = Cu + Cu2+ + H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是???????????? 。
②反应Ⅰ完成后,铁元素的存在形式为??????????? 。(填离子符号)
请写出生成该离子的离子方程式??????????????????????????????????????? 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是????????????? 。
④下列关于NaClO调pH的说法正确的是???????? (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为????????? 。
查看习题详情和答案>>

①电极b发生 (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
已知: Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是 。
②反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是 。
④下列关于NaClO调pH的说法正确的是 (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+
 HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O
 HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
(15分)A、B、C、D、E、F是原子半径依次减小的短周期元素,A、C两元素形成的化合物是厨房中最常用的调味品,A、B、C的最高价氧化物对应的水化物两两间均能反应生成盐和水;D元素的同位素之一被用来作为相对原子质量和阿伏加德罗常数的标准;E元素能形成多种同素异形体,其中一种是导致许多食品、药品变质的气体;F元素的氧化物是许多有机物燃烧的液态生成物。据此回答:
(1)A、C、E按原子个数之比1 :1 :1形成的化合物是一种常见的消毒剂,将该消毒剂的水溶液滴在pH试纸上,可观察到现象是 ,原因是 。
(2)我国首创的海洋电池以B的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为 ,电池总反应的化学方程式为 。
(3)C的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式: ____________________________________。
(4)在1 L的密闭容器中,充入1 mo1DE和1 mo1 F2E (g),于850℃时进行化学反应:DE (g) + F2E (g) DE2(g)
+ F2(g) △H<0,达平衡时,有50%的DE转化为DE2。在相同温度下,将1 mo1DE和4
mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
DE2(g)
+ F2(g) △H<0,达平衡时,有50%的DE转化为DE2。在相同温度下,将1 mo1DE和4
mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
|
时间/min |
n(DE)/ mo1 |
n(F2E)/mo1 |
n(DE2)/ mo1 |
n(F2)/ mo1 |
|
0 |
1 |
4 |
0 |
0 |
|
4 |
0.25 |
3.25[来源:学。科。网Z。X。X。K] |
0.75 |
0.75 |
|
6 |
n1 |
n2 |
n3 |
n4 |
|
8 |
n1 |
n2 |
n3 |
n4 |
|
t |
0.15 |
3.15 |
0.85 |
0.85 |
①反应在第4 min时,v(正) v(逆)(填“>”、“=”或“<”)。
②8分钟时,混合气体中DE2的体积分数为 。
③t分钟时,反应所处的温度 850℃(填“>”、“=”或“<”)。
查看习题详情和答案>>