题目内容
(1)高温电解技术能高效实现CO2(g) + H2O(g) =CO(g) + H2(g) +O2(g)? ,工作原理示意图如下:
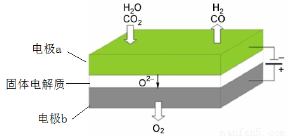
①电极b发生??????? (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是?????????????????????????????? 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+? = Cu + Cu2+ + H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是???????????? 。
②反应Ⅰ完成后,铁元素的存在形式为??????????? 。(填离子符号)
请写出生成该离子的离子方程式??????????????????????????????????????? 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是????????????? 。
④下列关于NaClO调pH的说法正确的是???????? (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为????????? 。
(1)① 氧化(2分)??? ② CO2 + 2e- = CO+O2-(2分)
(2)①SiO2、Cu(各1分)? ②Fe2+ (2分)???? 2Fe3+ + Cu = Cu2+ + 2Fe2+(2分)
③5.2≤pH<5.4? (2分)?? ④ b (2分)?? ⑤ 5:11 (3分)
【解析】
试题分析:(1)①根据工作原理示意图可知,电极b上O2?转化为O2,失去电子发生氧化反应。
②CO2在电极a上得电子,转化为CO和O2?,电极方程式为:CO2 + 2e- = CO+O2-
(2)①SiO2为不溶于硫酸的难溶物,根据信息:Cu2O + 2H+? = Cu + Cu2+ + H2O,所以加入稀硫酸后得到固体混合物含SiO2、Cu
②因为固体混合物中有单质Cu存在,所以Fe元素的存在形式为Fe2+;发生Cu还原Fe3+的反应:2Fe3+ + Cu = Cu2+ + 2Fe2+
③加入NaOH调pH=y的目的是让Al3+转化为Al(OH)3沉淀,所以y对应的数值范围是5.2≤pH<5.4
④a、加入NaClO使溶液的pH升高,错误;b、因为HClO为弱酸,所以加入NaClO后发生反应:ClO-+ H+ HClO,使溶液pH升高,正确;c、NaClO溶液只有少量ClO?发生水解反应,ClO?浓度大, NaClO能调节pH的主要原因是发生发生反应:ClO-+ H+
HClO,使溶液pH升高,正确;c、NaClO溶液只有少量ClO?发生水解反应,ClO?浓度大, NaClO能调节pH的主要原因是发生发生反应:ClO-+ H+ HClO,错误。
HClO,错误。
⑤设CuSO4?5H2O的质量为x,H2O的质量为y,则160/250x÷(x+y)×100%=20%,可得x:y=5:11。
考点:本题考查化学工艺流程的分析、电解原理及应用、质量分数的计算。

科学家一直致力于“人工固氮”的新方法研究。
 (1)目前合成氨技术原理为:N2(g) + 3H2(g)
(1)目前合成氨技术原理为:N2(g) + 3H2(g)![]() 2NH3(g);
2NH3(g);
△H=—92.4kJ·mol—1。
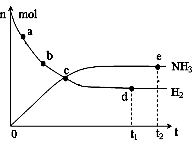
① 673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随
时间变化的关系如右图所示。下列叙述正确的是 。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点 e处的n(N2)相同
D.773K,30MPa下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
② 在容积为2.0 L恒容的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下反应N2(g) + 3H2(g)![]() 2NH3(g)的平衡常数K= 。K值越大,表明反应达到平衡时 。(填标号)。
2NH3(g)的平衡常数K= 。K值越大,表明反应达到平衡时 。(填标号)。
A.化学反应速率越大 B.NH3的产量一定越大 C.正反应进行得越完全
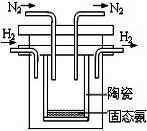 (2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性
的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电
解合成氨。其实验装置如图,阴极的电极反应式 。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,
N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+ 3H2O(1) ![]() 2NH3(g)+
2NH3(g)+ ![]() O2(g) △H = a kJ·mol—1
O2(g) △H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a 0;ΔS 0(填“>”、“<”或“=”);该反应属于
A.一定自发 B.一定不自发 C.高温自发 D.低温自发
②已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则N2(g)+ 3H2O(1) = 2NH3(g) + ![]() O2(g)ΔH= kJ·mol—1。
O2(g)ΔH= kJ·mol—1。

 2NH3(g); △H=-92.4kJ·mol-1。
2NH3(g); △H=-92.4kJ·mol-1。 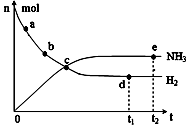
 2NH3(g)的平衡常数K= ________。(保留小数一位)K值越大,表明反应达到平衡时_________(填标号)。
2NH3(g)的平衡常数K= ________。(保留小数一位)K值越大,表明反应达到平衡时_________(填标号)。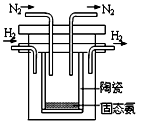
 2NH3(g) + O2(g)。△H = a kJ·mol-1 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
2NH3(g) + O2(g)。△H = a kJ·mol-1 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表 
 2NH3(g) ΔH= -92 .4kJ·mol-1
2NH3(g) ΔH= -92 .4kJ·mol-1  O2(g) ΔH=_____________kJ·mol-1
O2(g) ΔH=_____________kJ·mol-1