网址:http://m.1010jiajiao.com/timu_id_139901[举报]
生物答案:
1B 2A 3C 4A 5D
30.
Ⅰ.(12分)
⑴
①等量生理盐水。(2分)
③取出标本,在1号中加入适量生理盐水稀释的有机磷农药,2号滴加等量生理盐水(2分)
④同时给两个标本施加相同的电刺激(2分)
振颤不止(或持续收缩)(2分)
正常收缩并及时舒张(2分)
⑵肌肉不收缩或无变化(2分)
Ⅱ.(10分)
⑴糖类、脂肪(2分) ③(2分) 胰岛素(2分)
⑵基因突变(2分) 核糖体、内质网、高尔基体、线粒体(2分)
31.
Ⅰ.(10分)
(1)B(2分) B→D→A→C(2分) 11.3%(2分)(2)水中的溶解氧 (2分)
控制污染物的排放,(1分) 避免过量捕捞。(1分)(其它正确答案正确给分)
Ⅱ.(10分)
⑴X(2分) 隐(2分)
⑵bbXaXa(2分) 7/12 (2分)
⑶ Ⅱ2 Ⅱ3 Ⅲ1 Ⅲ2(2分)
化学答案:
6.D7.C8.C 9.B 10.D 11.C12.A13.B
26.(14分,每空2分)
(1)分子
(2)①非极性 ②镁条在二氧化碳中剧烈燃烧,生成白色粉末,在瓶的内壁有黑色固体附着
(3)电解法
(4)高温常压催化剂
27.(14分,每空2分)(1)①2OH-+CO2==CO32-+H2O ② AC
(2)①c(Na+)>c(AlO2-)>c(OH-)>c(H+) ②Al3++3AlO2-+6H2O==4Al(OH)3↓
(3)①2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
②离子键和极性键(或共价键)
③用湿润的红色石蕊试纸,若变蓝则证明为氨气
28.(16分)(一)(1)28.0 C (各1分)
(2)蒸发皿 5.8或5.9 100 mL容量瓶 (各1分)
(二)(1)能 (1分) (2)⑤和⑥ (1分) ①和⑥ (1分)
4Fe(OH)2+O2+2H2O==4Fe(OH)3(2分)
(3)3Fe2++4H++NO3―==3Fe3++NO↑+2H2O
2Fe2++2H++H2O2==2Fe3++2H2O
2Fe2++4OH一+H2O2==2Fe(OH)3↓(以上任写两组)(4分)
(4)② 几枚铁钉(2分)
29.(16分)
(1)C10H10O4 (2分) (2)羧基(2分) a、c (2分)
(3) (2分)
(2分)
(4)
(2分)酯化反应(1分)
(5)3 (1分) (2分)
物理答案:
14、AC 15、BC 16、A 17、CD 18、D 19、C 20、D 21、A
22、(1)BC 3分 (2)dacb 3分 (3)A 3分
(4)I、共6分 分压2分 测量4分
II、3分
23、(16分)解:把小球斜抛看成反向平抛:
2分
2分
2分 vx=10m/s vy=5m/s
2分
Mv-mvx=0 3分 v=1m/s
W= 3分
W=675J 2分
24、(16分)(1)电场对电子做负功,由动能定理
4分 2分
(2)在nT一(n+1)T的时间内,剪半周期电子减速通过输入腔,射出的速度为v1
4分
1分
后半周期电子加速通过输入腔,射出的速度为v2,
4分
解得 1分 3分
25、(20分)解:⑴做直线运动有: 2分
做圆周运动有: 2分
只有电场时,粒子做类平抛,有:
3分
解得: 粒子速度大小为:
速度方向与x轴夹角为: 2分
粒子与x轴的距离为: 2分
⑵撤电场加上磁场后,有: 解得: 2分
粒子运动轨迹如图所示,圆心C位于与速度v方向垂直的直线上,该直线与x轴和y轴的夹角均为π/4,有几何关系得C点坐标为:
过C作x轴的垂线,在ΔCDM中:
解得: 5分
M点横坐标为: 2分
(1)F元素在周期表中的位置为
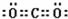
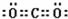
(2)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为
(3)科学研究证明:化学反应热只与始终态有关,与过程无关.单质B的燃烧热为a kJ/mol.由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式
| 1 |
| 2 |
| 1 |
| 2 |
(4)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为
(1)B的最高价氧化物对应的水化物与C的氧化物在溶液中反应的离子方程式为:
(2)B、D的最高价氧化物对应的水化物在稀溶液中反应,若生成0.25mol水时放出Q kJ的热量,则该反应的热化学方程式为
(3)在BHCO3的水溶液中,c(B+)-c(H2CO3)=
(4)在一定条件下,将2molA2和3molH2在一固定体积的密闭容器中反应达到平衡状态,此时容器中混合气体的平均相对分子质量为15.5,则H2的转化率为
试回答:
(1)化合物ABC中σ键和π键个数比为


(2)A、D、E 三种元素可形成一种离子化合物R,用惰性电极电解 R 的稀溶液,电解一段时间后,溶液 pH
(3)在0.1mol?L-1E2BD3的溶液中,各离子浓度由大到小的顺序是
(4)某密闭容器中发生如下反应:C2(g)+3A2(g)?2CA3(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
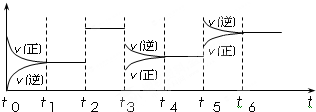
A.t5时增大了压强 B.t3时降低了温度
C.t2时加入了催化剂 D.t4~t5时间内转化率一定最低
(5)单质A的燃烧热为akJ/mol,12gB单质燃烧生成化合物BD放出热量bkJ,1mol化合物A2D由液态变为气态需吸收热量ckJ,写出单质B制水煤气的热化学方程式
(14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式: ;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是。
A.达到平衡所需要的时间:I>II B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
查看习题详情和答案>>
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为__________.
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为__________.
(3)单质B的燃烧热a kJ/mol.由B、C二种元素组成的化合物BC14g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式:____________.
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1mol A2C和1mol BC、2mol A2C和2mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是__________
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极,浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是____________
查看习题详情和答案>>