网址:http://m.1010jiajiao.com/timu_id_120921[举报]
难点磁场
提示:根据电荷守恒,可知A错B对。根据由水电离产生的H+和OH-个数相等,可知C对。根据Na2S中,Na+个数是S2-的两倍,可知D对。
答案:BCD
歼灭难点训练
1.提示:常温下,c(H+)=1.0×10-7 mol?L-1,即每升水中已电离的水的物质的量是1.0×10-7 mol,而每升水的物质的量是――水的电离.files/image045.gif) ,则:
,则:
n=――水的电离.files/image047.gif) mol∶10-7 mol=5.56×108
mol∶10-7 mol=5.56×108
答案:B
2.提示:本题有两种解法。
方法1(常规解法):NaOH(aq)中:
c水(OH-)=c水(H+)=――水的电离.files/image049.gif) mol?L-1=1.0×10-5 mol?L-1
mol?L-1=1.0×10-5 mol?L-1
CH3COONa(aq)中:
c′水(OH-)=c′总(OH-)=10-9 mol?L-1
则A∶B=10-4
方法2(巧解法):NaOH(aq)中,水的电离被抑制;CH3COONa(aq)中,水的电离被促进;故A<B。
答案:B
3.提示:c水(H+)=1.0×10-13 mol?L-1,则该溶液可能是强碱性溶液,也可能是强酸性溶液,总之,水的电离被抑制。因而“一定不可能大量存在”是指酸性和碱性条件下都不能大量存在。
答案:BC
评注:若去掉题干中的“不可”,则选D。若去掉题干中的“一定不”,则选AD。
4.提示:Na3PO4完全电离,水部分电离:
――水的电离.files/image007.jpg) Na3PO4====3Na++PO
Na3PO4====3Na++PO――水的电离.files/image043.gif)
H2O――水的电离.files/image052.jpg) H++OH-
H++OH-
PO――水的电离.files/image043.gif) 发生系列水解:
发生系列水解:
PO――水的电离.files/image043.gif) +H2O
+H2O――水的电离.files/image054.jpg) HPO
HPO――水的电离.files/image039.gif) +OH-
+OH-
HPO――水的电离.files/image039.gif) +H2O
+H2O――水的电离.files/image054.jpg) H2PO
H2PO――水的电离.files/image058.gif) +OH-
+OH-
H2PO――水的电离.files/image058.gif) +H2O
+H2O――水的电离.files/image054.jpg) H3PO4+OH-
H3PO4+OH-
答案:8
(1)c(Na+)+c(H+)==c(OH-)+――水的电离.files/image043.gif) )+
)+――水的电离.files/image039.gif) )+c(H2PO
)+c(H2PO――水的电离.files/image058.gif) )
)
(2)c(H+)+c(HPO――水的电离.files/image039.gif) )+
)+――水的电离.files/image058.gif) )+
)+
(3)c(Na+)==――水的电离.files/image043.gif) )+
)+――水的电离.files/image039.gif) )+
)+――水的电离.files/image058.gif) )+
)+
w.w.w.k.s.5.u.c.o.m
――水的电离.files/image002.gif) www.ks5u.com
www.ks5u.com
下列有关溶液中粒子浓度的关系式中,正确的是

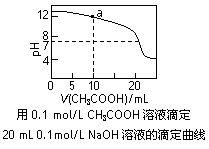
A.pH相同的①CH3COONa、②NaHCO3、③  三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
查看习题详情和答案>>
下列有关溶液中粒子浓度的关系式中,正确的是( )
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③  三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)