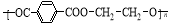��Ŀ����
�����й���Һ������Ũ�ȵĹ�ϵʽ�У���ȷ���ǣ�������

A��pH��ͬ����CH3COONa����NaHCO3����Na2CO3������Һ�е�c(Na��)������������
B��0.1mol��L��1ij��Ԫ����ǿ����NaHA��Һ�У� c(Na+)=2c(A2-)��c(HA-)��c(H2A)
C��ͼ��pH��7ʱ��c(Na��)��c(CH3COO��) ��c(OH��)��c(H��)
D��ͼ��a����Һ�и�����Ũ�ȵĹ�ϵ����c(OH��)��c(H��)��c(CH3COO��)��2c(CH3COOH)
D
��������
���������A����֪���ԣ����̼�̼�����ƣ�����Խǿ����Ӧ����ˮ��̶�Խ��pH��ͬʱ��Ũ�ȣ���������������A����B��NaHA��Һ�д��������غ㣺c��Na+��=c��A2����+c��HA����+c��H2A������B����C��ͼ��pH=7ʱ��c��OH����=c��H+������c��Na+��+c��H+��=c��CH3COO����+c��OH��������c��Na+��=c��CH3COO��������C����D��a����Һ����ΪNaOH��CH3COONa����Һ�д��ڵ���غ㣺c��CH3COO����+c��OH����=c��H+��+c��Na+���������غ㣺c��Na+��=2c��CH3COO����+2c��CH3COOH����������ʽ�ɵã�c��OH����=c��H+��+c��CH3COO����+2c��CH3COOH������D��ȷ����ѡD��
���㣺���⿼������Ũ�ȴ�С�ıȽϣ���Ŀ�Ѷ��еȣ������״���ΪD��ע����Һ���غ㷽����Ӧ�á�