摘要:设计如下方案进行探究:
网址:http://m.1010jiajiao.com/timu_id_115090[举报]
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应.
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式
(2)甲同学设计的实验
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入括号,并写出装置内所放的化学药品.

(
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是
查看习题详情和答案>>
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式
CaC2+2H2O→C2H2↑+Ca(OH)2 HC≡CH+Br2→ 或HC≡CH+2Br2→
或HC≡CH+2Br2→
 或HC≡CH+2Br2→
或HC≡CH+2Br2→
CaC2+2H2O→C2H2↑+Ca(OH)2 HC≡CH+Br2→ 或HC≡CH+2Br2→
或HC≡CH+2Br2→
. 或HC≡CH+2Br2→
或HC≡CH+2Br2→
(2)甲同学设计的实验
不能
不能
(填能或不能)验证乙炔与溴发生加成反应,其理由是a、c
a、c
.(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是
H2S
H2S
,它与溴水反应的化学方程式是Br2+H2S═S↓+2HBr
Br2+H2S═S↓+2HBr
;在验证过程中必须全部除去.(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入括号,并写出装置内所放的化学药品.

(
c
c
)→(b)→(CuSO4
CuSO4
)→(d)(硫酸铜)d
d
(溴水)(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是
如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证.
如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证.
.某探究性学习小组用如图所示的装置和药品探究Cl2的化学性质: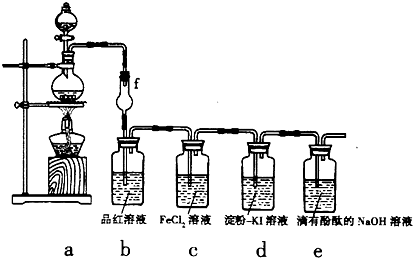
试回答下列问题:
(1)用图中a装置来制取Cl2,则浓盐酸应放入a装置的
(2)该实验方案存在的主要缺陷是
(3)①当a中产生足量氯气时,b装置内的现象为
②c装置内溶液由浅绿色变为黄色,为检验c装置内生成的阳离子,某同学进行了如下实验:向反应后的溶液中先滴加KSCN溶液,溶液呈血红色,再向其中滴加过量的新制氯水时,发现溶液的血红色褪去.为了弄清溶液血红色褪去的原因,同学们查到如下资料:
Ⅰ.铁元素可形成铁酸盐(含有Fe
);
Ⅱ.SCN-的电子式为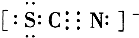 ;
;
Ⅲ.氯水具有很强的氧化性.
于是同学们提出以下两种假设:
假设一:Cl2可将Fe3+氧化成Fe
,请写出该反应的离子方程式:
假设二:
查看习题详情和答案>>

试回答下列问题:
(1)用图中a装置来制取Cl2,则浓盐酸应放入a装置的
分液漏斗
分液漏斗
(填仪器名称)中.(2)该实验方案存在的主要缺陷是
缺少尾气处理装置,易造成大气污染
缺少尾气处理装置,易造成大气污染
.(3)①当a中产生足量氯气时,b装置内的现象为
溶液由红色变为无色
溶液由红色变为无色
,f装置的作用是防止倒吸
防止倒吸
.②c装置内溶液由浅绿色变为黄色,为检验c装置内生成的阳离子,某同学进行了如下实验:向反应后的溶液中先滴加KSCN溶液,溶液呈血红色,再向其中滴加过量的新制氯水时,发现溶液的血红色褪去.为了弄清溶液血红色褪去的原因,同学们查到如下资料:
Ⅰ.铁元素可形成铁酸盐(含有Fe
| O | 2- 4 |
Ⅱ.SCN-的电子式为
 ;
;Ⅲ.氯水具有很强的氧化性.
于是同学们提出以下两种假设:
假设一:Cl2可将Fe3+氧化成Fe
| O | 2- 4 |
2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+
2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+
.假设二:
SCN-被氯气氧化
SCN-被氯气氧化
,提出该假设的理论依据是SCN-中S、N元素处于最低价态
SCN-中S、N元素处于最低价态
.欲探究上述假设是否成立,可设计的实验方案为向褪色后的溶液中加入适量的硫氰化钾溶液,若溶液恢复血红色,则假设二成立,若溶液不恢复血红色,则假设一成立
向褪色后的溶液中加入适量的硫氰化钾溶液,若溶液恢复血红色,则假设二成立,若溶液不恢复血红色,则假设一成立
.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔和溴发生了加成反应.乙同学发现甲同学的实验中,褪色的溶液里有少许淡黄色浑浊,推测甲在制得的气体中还含有少量的还原性杂质气体,由此乙同学提出必先将其除去,再与溴水反应.请回答下列问题:
(1)写出甲同学实验中两个主要反应的化学方程式:
(2)甲同学设计的实验
A 使溴水褪色的反应,未必是加成反应 B 使溴水褪色的反应就是加成反应
C 使溴水褪色的物质,未必是乙炔 D 使溴水褪色的物质,就是乙炔
(3)乙同学推测乙炔气体中必定含有一种杂质气体是(填化学式)
(4)如果选用下列编号为A、B、C、D的四种装置(有的可重复使用)来实现乙同学的实验方案.

请你写出所选择装置编号(填在方框中)及装置中的化学药品名称(填在括号内)
查看习题详情和答案>>
(1)写出甲同学实验中两个主要反应的化学方程式:
CaC2+2H2O→Ca(OH)2+C2H2↑
CaC2+2H2O→Ca(OH)2+C2H2↑
、CH≡CH+2Br2→CHBr2-CHBr2
CH≡CH+2Br2→CHBr2-CHBr2
.(2)甲同学设计的实验
不能
不能
(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是AC
AC
(多选扣分)A 使溴水褪色的反应,未必是加成反应 B 使溴水褪色的反应就是加成反应
C 使溴水褪色的物质,未必是乙炔 D 使溴水褪色的物质,就是乙炔
(3)乙同学推测乙炔气体中必定含有一种杂质气体是(填化学式)
H2S
H2S
,它与溴反应的化学方程式是Br2+H2S═S↓+2HBr
Br2+H2S═S↓+2HBr
.验证乙炔气体的过程中必须全部除去.(4)如果选用下列编号为A、B、C、D的四种装置(有的可重复使用)来实现乙同学的实验方案.

请你写出所选择装置编号(填在方框中)及装置中的化学药品名称(填在括号内)
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体.由此他提出必须先除去杂质,再与溴水反应.请回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式
(2)甲同学设计的实验
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是
反应的化学方程式是
(4)请你选用下列四个装置(见图,可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品.

(电石、水)
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性.理由是
查看习题详情和答案>>
(1)写出甲同学实验中两个主要的化学方程式
CaC2+2H2O→Ca(OH)2+C2H2↑
CaC2+2H2O→Ca(OH)2+C2H2↑
;CH≡CH+2Br2→CHBr2-CHBr2
CH≡CH+2Br2→CHBr2-CHBr2
.(2)甲同学设计的实验
不能
不能
(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是ac
ac
.a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是
H2S
H2S
它与溴水反应的化学方程式是
Br2+H2S═S↓+2HBr
Br2+H2S═S↓+2HBr
,在验证过程中必须全部除去.(4)请你选用下列四个装置(见图,可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品.

(电石、水)
硫酸铜溶液或是氢氧化钠溶液
硫酸铜溶液或是氢氧化钠溶液
硫酸铜溶液
硫酸铜溶液
(溴水)(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性.理由是
如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证
如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证
.
某探究小组废弃的印刷线路板(含Cu、Al少量Au、Pt等金属的混合物回收Cu并制备硫酸铝晶体[Al2(SO4)3.18H2O],设计路线如下:
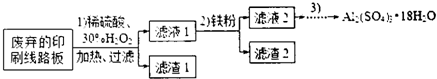
(1)过滤时所需要的玻璃仪器有玻璃棒、 、 .
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是 .
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:2Cu2++4I-=2CuI(白色)↓+I2,2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用 .
②滴定终点观察到的现象为 .
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会 (填“偏高”、“偏低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
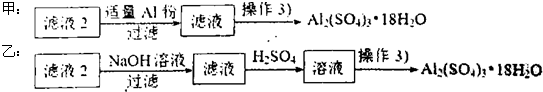
①操作③的实验步骤依次为:蒸发浓缩: 、 、洗涤.
②从原子利用率角度考虑, 方案更合理.(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
①氧化需加入H2O2而不用Cl2的原因是 .
②调节溶液pH约为 .
查看习题详情和答案>>

(1)过滤时所需要的玻璃仪器有玻璃棒、
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:2Cu2++4I-=2CuI(白色)↓+I2,2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用
②滴定终点观察到的现象为
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:

①操作③的实验步骤依次为:蒸发浓缩:
②从原子利用率角度考虑,
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.8 | 5.2 |
②调节溶液pH约为