题目内容
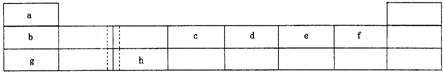
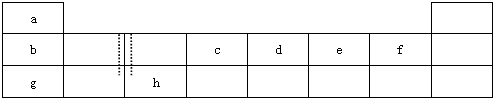
下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语或符号回答下列问题:
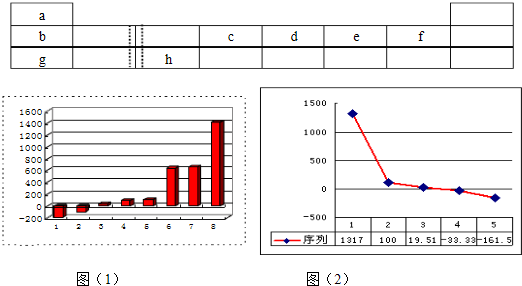
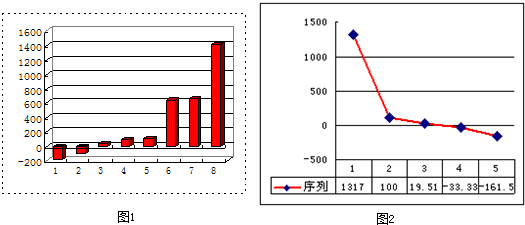
(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是
(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
 .
.
(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是
A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是
 .
.
(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是
A.钠晶胞结构如右图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如右图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径.

(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是
原子
原子
晶体(填晶体的类型).(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
甲烷
甲烷
,序列“2”的氢化物的结构式为

(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是
BC
BC
(填选项序号)A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是



(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是
BD
BD
(选填序号)A.钠晶胞结构如右图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如右图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径.
分析:根据元素在周期表中的位置,可知a为H,b为Li,c为C,d为N,e为O,f为F,g为Na,h为Al,
(1)第三周期8种元素单质中,只有Si为原子晶体,熔点最大;
(2)b、c、d、e、f分别为Li、C、N、O、F,沸点最高为离子化合物LiH,水的沸点为100℃,序列“2”为水,HF分子之间、氨气分子之间都存在氢键,沸点比较甲烷高,沸点最低的为甲烷;
(3)比较电负性可以根据:与氢气反应难易程度、氢化物稳定性、单质的氧化性、元素相互化合时化合物中元素的化合价,与变价金属反应时金属的化合价、再根据含氧酸的酸性等比较,不能利用物理性质比较,与获得电子数目多少无关、与获得电子的难易有关,注意O、F没有含氧酸;
(4)氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,每个Al原子与4个Cl原子成键,形成3个共价键,同时氯原子提供孤对对子,铝原子提供空轨道还形成1个配位键,2个Al原子通过2个Cl原子连接;
(5)A.根据晶胞结构可知,Na为体心立方结构,Na原子配位数为8;
B.根据均摊法计算晶胞中Na原子数目;
C.同周期自左而右电负性增大;
D.电子层结构相同核电荷数越大离子半径越小.
(1)第三周期8种元素单质中,只有Si为原子晶体,熔点最大;
(2)b、c、d、e、f分别为Li、C、N、O、F,沸点最高为离子化合物LiH,水的沸点为100℃,序列“2”为水,HF分子之间、氨气分子之间都存在氢键,沸点比较甲烷高,沸点最低的为甲烷;
(3)比较电负性可以根据:与氢气反应难易程度、氢化物稳定性、单质的氧化性、元素相互化合时化合物中元素的化合价,与变价金属反应时金属的化合价、再根据含氧酸的酸性等比较,不能利用物理性质比较,与获得电子数目多少无关、与获得电子的难易有关,注意O、F没有含氧酸;
(4)氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,每个Al原子与4个Cl原子成键,形成3个共价键,同时氯原子提供孤对对子,铝原子提供空轨道还形成1个配位键,2个Al原子通过2个Cl原子连接;
(5)A.根据晶胞结构可知,Na为体心立方结构,Na原子配位数为8;
B.根据均摊法计算晶胞中Na原子数目;
C.同周期自左而右电负性增大;
D.电子层结构相同核电荷数越大离子半径越小.
解答:解:根据元素在周期表中的位置,可知a为H,b为Li,c为C,d为N,e为O,f为F,g为Na,h为Al,
(1)第三周期8种元素单质中,只有Si为原子晶体,熔点最大,柱形“8”代表是晶体硅,故答案为:原子;
(2)b、c、d、e、f分别为Li、C、N、O、F,沸点最高为离子化合物LiH,水的沸点为100℃,序列“2”为水,HF分子之间、氨气分子之间都存在氢键,沸点比较甲烷高,沸点最低的为甲烷,序列“5”的氢化物的名称为甲烷,与序列2对应的水的结构式为 ,故答案为:甲烷;
,故答案为:甲烷; ;
;
(3)A.单质颜色属于物理性质,不能比较非金属性强弱,故A错误;
B.f单质与e的氢化物剧烈反应,产生e的单质,说明f单质氧化性强于e单质的氧化性,则f的非金属性更强,故B正确;
C.f与e形成的化合物中e元素呈正价态,说明f对键合电子的吸引力更强,则f的非金属性更强,故C正确;
D.非金属性与获得电子数目多少无关、与获得电子的难易有关,故D错误;
故答案为:BC;
(4)氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,每个Al原子与4个Cl原子成键,形成3个共价键,同时氯原子提供孤对对子,铝原子提供空轨道还形成1个配位键,2个Al原子通过2个Cl原子连接,所以结构式为 ,故答案为:
,故答案为: ;
;
(5)A.根据晶胞结构可知,Na为体心立方结构,Na原子配位数为8,故A错误;
B.根据晶胞结构可知,Na为体心立方结构,晶胞内部有1个钠原子,其处于晶胞顶点上,则晶胞中Na原子数目=1+8×
=2,故B正确;
C.同周期自左而右电负性增大,故氧的电负性更大,故C错误;
D.Na+、N3-的电子层结构相同,核电荷数越大离子半径越小,故离子半径Na+<N3-,故D正确;
故答案为:BD.
(1)第三周期8种元素单质中,只有Si为原子晶体,熔点最大,柱形“8”代表是晶体硅,故答案为:原子;
(2)b、c、d、e、f分别为Li、C、N、O、F,沸点最高为离子化合物LiH,水的沸点为100℃,序列“2”为水,HF分子之间、氨气分子之间都存在氢键,沸点比较甲烷高,沸点最低的为甲烷,序列“5”的氢化物的名称为甲烷,与序列2对应的水的结构式为
 ,故答案为:甲烷;
,故答案为:甲烷; ;
;(3)A.单质颜色属于物理性质,不能比较非金属性强弱,故A错误;
B.f单质与e的氢化物剧烈反应,产生e的单质,说明f单质氧化性强于e单质的氧化性,则f的非金属性更强,故B正确;
C.f与e形成的化合物中e元素呈正价态,说明f对键合电子的吸引力更强,则f的非金属性更强,故C正确;
D.非金属性与获得电子数目多少无关、与获得电子的难易有关,故D错误;
故答案为:BC;
(4)氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,每个Al原子与4个Cl原子成键,形成3个共价键,同时氯原子提供孤对对子,铝原子提供空轨道还形成1个配位键,2个Al原子通过2个Cl原子连接,所以结构式为
 ,故答案为:
,故答案为: ;
;(5)A.根据晶胞结构可知,Na为体心立方结构,Na原子配位数为8,故A错误;
B.根据晶胞结构可知,Na为体心立方结构,晶胞内部有1个钠原子,其处于晶胞顶点上,则晶胞中Na原子数目=1+8×
| 1 |
| 8 |
C.同周期自左而右电负性增大,故氧的电负性更大,故C错误;
D.Na+、N3-的电子层结构相同,核电荷数越大离子半径越小,故离子半径Na+<N3-,故D正确;
故答案为:BD.
点评:本题考查位置结构性质关系应用,涉及元素周期律、晶体结构与性质、晶胞、常用化学用语等,难度中等,注意(2)中晶体结构与性质关系.

练习册系列答案
相关题目
(8分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语或符号回答下列问题:
| a | | | | | | | |
| b | | | c | d | e | f | |
| g | | h | | | | | |

(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是 晶体(填晶体的类型)。
(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
,序列“2”的氢化物的结构式为 。
(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是 (填选项序号)
A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是_______________。
(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是_____________(选填序号)

A.钠晶胞结构如图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径