网址:http://m.1010jiajiao.com/timu_id_100811[举报]
选择题:
1、B 2、C 3、C 4、B 5、D 6、A 7、B
8、D 9、A 10、D 11、B 12、C 13、D 14、D
15、B 16、AD 17、BC 18、C 19、BD 20、C 21、B
22. (1)
(2)电路图……4分,实物图……4分



(3) ,……2分
,……2分  ……2分
……2分
23.(17分)货箱先相对平板车向左滑,当与平板车的速度相等后相对平板车向右滑。若货箱与平板车的速度相等时,货箱仍未从平板车上掉下来,则以后货箱不会从平板上掉下来。
设经过时间t,货箱和平板车达到共同速度v,以货箱为研究对象,由牛顿第二定律得,货箱向右作匀加速运动的加速度 a1=μg ① (1分)
货箱向右运动的位移 S箱=a1t2 ② (2分)
又 v= a1 t ③ (2分)
平板车向右运动的位移 S车=v02-at2 ④ (2分)
又 v= v0-a t ⑤ (2分)
为使货箱不从平板车上掉下来,应满足:S箱+LㄒS车 ⑥ (3分)
联立方程①~⑥解得:
代入数据: (5分)
(5分)
如利用其它方法求解,参照评分细则给分。
24.(18分)

 ……2分
……2分
 ……2分
……2分 …4分
…4分
 =
= ……3分
……3分 (5)(4分)50% [解:设2molN2转化xmol,由:
(5)(4分)50% [解:设2molN2转化xmol,由: (3x)6/(2-x)2=729 (3x)3/(2-x)=27 得:x3+x-2=0 只能:x=1 故转化50%]
(3x)6/(2-x)2=729 (3x)3/(2-x)=27 得:x3+x-2=0 只能:x=1 故转化50%] (CH2O)+ O2 ((2分)
(CH2O)+ O2 ((2分) ,……3分
,……3分 ―OCH2CH
―OCH2CH

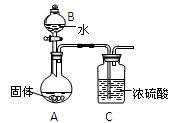



 (4)探究氨水与盐酸的反应过程。
(4)探究氨水与盐酸的反应过程。