2.元素的性质与原子结构关系
|
元素的分类 |
最外层电子数 |
稳定性 |
化学性质 |
|
稀有气体元素 |
一般是8个(氦为2个) |
稳定 |
相对稳定不易得失电子 |
|
金属元素 |
较少(一般少于4个) |
不稳定 |
易失最外层电子 |
|
非金属元素 |
较多(一般4-7个) |
不稳定 |
易得电子 |
①元素的性质,特别是化学性质主要由元素原子的______________决定;
②元素的分类由元素原子的_______________决定;
③元素的种类由元素原子的_______________决定;
④决定元素化合价的粒子是原子的最外层电子数;
⑤决定原子质量的大小主要是原子核内质子与中子的质量。
3.化学方程式
(1)质量守恒定律 参加化学反应的各物质质量_______,等于反应后生成的各物质的质量_______,这个规律叫质量守恒定律。质量守恒的原因是:化学反应的过程,就是原子的重新组合过程,在这个过程中,反应前后原子的________、_______、______都没有改变,因此化学反应前后各物质的质量总和必然相等。
[注意]化学反应前后⑴一定改变的是:①物质种类,②分子种类;⑵一定不变的是:①物质总质量,②元素种类③元素质量④原子种类⑤原子个数⑥原子质量;⑶可能改变的是:①分子个数②元素的化合价
[思考1]将一定质量的镁条在空气中点燃,完全燃烧后,生成氧化镁的质量与镁条相比,是不变,增大还是减小?为什么?
答:增大。因为镁条在空气中燃烧,是镁和氧气发生了化学反应,根据质量守恒定律,反应后生成氧化镁的质量必定等于镁条的质量和参加反应的氧气的质量之和,所以,氧化镁的质量比镁条的质量增大。
[思考2]把6.2g 红磷放在给定的氧气中充分燃烧,实验数据如下:
⑴这三次实验,哪一次符合质量守恒定律?为什么?⑵第一次实验为什么不生成10.2g 的五氧化二磷?哪种物质有剩余?剩余多少?③第二次实验为什么不生成24.2g 的五氧化二磷?哪种物质有剩余?剩余多少g ?
|
|
第一次 |
第二次 |
第三次 |
|
给定氧气的质量/g |
4 |
18 |
8 |
|
生成五氧化二磷的质量/g |
7.1 |
14.2 |
14.2 |
答:在这三次实验的化学反应中,都遵循质量守恒定律。反应中剩余的一部分不参加反应。参加反应的那部分物质和生成物的质量相等,均符合质量守恒定律。第一次实验中,4g O2只能和3.1g P反应生成7.1g P2O5 ,所以不能生成10.2g P2O5 。P有剩余,剩余3.1g 第二次实验,6.2gP只能和8g O2反应生成14.2g P2O5 ,所以不能生成24.2g P2O5 。O2有剩余,剩余10g 。
[练习]将25g 甲物质跟5g 乙物质发生反应,所得混合物中含有10g 甲物质、11g 丙物质,还有另一种物质丁,若甲、乙、丙、丁的相对分子质量分别为30、20、44、18,化学式分别为A、B、C、D,则表示它们之间的化学方程式正确的是
A.A+B=C+D B.2A+B=C+2D C.2A+B=2C+D D.A+2B=2C+D
(2)化学方程式 用化学式来表示____________的式子叫化学方程式。
㈠ 书写原则:一是必须以_____________为基础;二是要遵守_____________________________。
㈡ 化学方程式的意义:① 表示反应物、生成物和反应条件;② 表示各物质间的质量比。
[思考]点燃的镁带可以在二氧化碳 气体中继续剧烈燃烧,生成炭和氧化镁,其反应的方程式为_______________________________。从这个化学方程式中你可获得哪些化学信息:
①________________________________________________________________;
②________________________________________________________________;
③________________________________________________________________;
④________________________________________________________________。
2. 元素
⑴ 具有___________(即质子数)的一类原子总称为元素。元素是宏观概念,只讲种类,不讲个数;元素与元素之间的区别是________________;
⑵ 同一种元素的原子或离子具有相同的质子数,但质子数相同的粒子不一定是同一种元素,如F和OH-的质子数都是9。
⑶ ①地壳中含量最多的四种元素为:氧(O)、硅(Si)、铝(Al)、铁(Fe)。②细胞中含量最多的四种元素为:氧(O)、碳(C)、氢(H)、氮(N)。③土壤中常缺乏的三种元素是:氮(N)、磷(P)、钾(K)。
⑷元素的性质与原子结构关系
|
元素的分类 |
最外层电子数 |
稳定性 |
化学性质 |
|
稀有气体元素 |
一般是8个(氦为2个) |
稳定 |
相对稳定不易得失电子 |
|
金属元素 |
较少(一般少于4个) |
不稳定 |
易失最外层电子 |
|
非金属元素 |
较多(一般4-7个) |
不稳定 |
易得电子 |
①元素的性质,特别是化学性质主要由元素原子的______________决定;
②元素的分类由元素原子的_______________决定;
③元素的种类由元素原子的_______________决定;
④决定元素化合价的粒子是原子的最外层电子数;
⑤决定原子质量的大小主要是原子核内质子与中子的质量。
⑸物质宏观上由元素组成,微观上由粒子(分子、原子、离子)构成。举例说明物质组成与构成的说法:
㈠ 由分子构成的物质,有三种说法(以二氧化碳为例)
① 二氧化碳是由氧元素和碳元素组成的。
② 二氧化碳是由二氧化碳分子构成的。
③ 每个二氧化碳分子是由两个氧原子和一个碳原子构成的。
㈡ 由原子(或离子)直接构成的物质(如汞、氯化钠),有两种说法:
① 汞是由汞元素组成的;氯化钠是由钠元素和氯元素组成的。
② 汞是由汞原子构成的;氯化钠是由钠离子和氯离子构成的。
[思考]在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,并填在相应的横线上。
①能直接构成纯净物的是 ②能保持物质化学性质的是
③化学变化中最小的粒子是 ④带正电荷的是
⑤不显电性的是 ⑥质量最小的是
⑦质量与氢原子近似相等的是 ⑧决定元素种类的是_______
⑹离子化合物与共价化合物 由_____________相互作用而构成的化合物叫离子化合物,如____________ 以___________形成分子的化合物叫共价化合物,如_______________。
⒊ 物质的分类
⑴混合物是由________________混合而成的。对于由分子构成的物质,混合物是由多种分子构成的。混合物的特点是无固定的组成和性质,无固定的熔点和沸点。混合物中各纯净物保持着各自的性质,相互间没有发生反应。
⑵ 纯净物是由一种物质组成的。对于由分子构成的物质,纯净物是由同种分子构成的。纯净物的特点是有固定的组成和性质,有固定的熔点和沸点。
⑶ 单质是由________元素组成的纯净物。化合物是由________元素组成的纯净物。
[思考]由同一种元素组成的物质一定是单质吗?_________________________________________
⑷ 无机物是指不含碳的化合物;有机物是指含碳的化合物。
[思考]CO、CO2、H2CO3和碳酸盐是有机物吗?__________________________________________
⑸酸 电离时生成的阳离子全部是氢离子的化合物叫酸。
[思考]NaHSO4是酸吗?为什么?________________________________________________________
① 含氧酸:酸分子中含有氧原子的酸,如_______、________;
② 无氧酸:酸分子中不含氧原子的酸,如______、________。
⑹碱 电离时生成的阴离子全部是氢氧根离子的化合物叫碱。
[思考] Cu2(OH)2CO3是碱吗?为什么?___________________________________________________
①可溶性碱:NaOH、KOH、Ba(OH)2、Ca(OH)2
②难溶性碱:Cu(OH)2 (蓝色)、Fe(OH)3(红褐色)、Mg(OH)2(白色)
⑺ 盐 电离时生成金属离子和酸根离子的化合物叫盐。
[思考]
◆写出下列盐的化学式,并命名:
①正盐:_____________________________________________________;
②酸式盐:___________________________________________________;
③碱式盐:___________________________________________________。
◆盐的组成中一定含有金属元素吗?__________________________________________________
⑻ 氧化物 含氧双元素的化合物叫氧化物。
①酸性氧化物 凡能跟_______起反应,生成___________的氧化物,如:_________________________。
②碱性氧化物 凡能跟________起反应,生成_________的氧化物,如:__________________________。
第五课时 化学用语与化学量
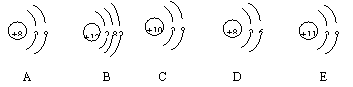 [例题]下面是几种粒子的结构示意图:
[例题]下面是几种粒子的结构示意图: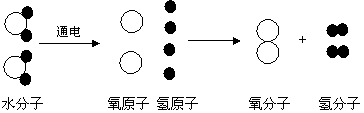 [例题]下图是电解水时水分子分解过程示意图。水分解的过程反映了哪些有关物质结构和变化的规律或结论?(至少写出四条)
[例题]下图是电解水时水分子分解过程示意图。水分解的过程反映了哪些有关物质结构和变化的规律或结论?(至少写出四条) 2H2 + O2
2H2 + O2 2H2O
2H2O Cu + H2O
Cu + H2O 2KCl
+ 3O2↑
2KCl
+ 3O2↑ CaO
+ CO2 E.H2
+ CuO
CaO
+ CO2 E.H2
+ CuO  Cu
+ H2O
F.HCl + NaOH ==NaCl + H2O
Cu
+ H2O
F.HCl + NaOH ==NaCl + H2O ⑴ 化合反应:(多变一) A + B + … M
⑴ 化合反应:(多变一) A + B + … M ⑵ 分解反应:(一变多) M A +
B + …
⑵ 分解反应:(一变多) M A +
B + … ⑷ 复分解反应:AB
+ CD
AD + CB
⑷ 复分解反应:AB
+ CD
AD + CB (2)化学式写法:
(2)化学式写法: