16.
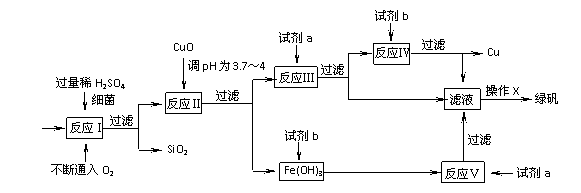 (8分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
(8分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
|
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
② 部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
|
沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
4.7 |
2.7 |
7.6 |
|
完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是 ▲ ,试剂b是 ▲ 。
(2)操作X应为蒸发浓缩、 ▲ 、 ▲ 。
(3)反应Ⅱ中加CuO调pH为3.7-4的目的是 ▲ ;
(4)反应Ⅴ的离子方程式为 ▲ 。
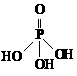 用△H1、△H2和△H3表示△H,△H= ▲
用△H1、△H2和△H3表示△H,△H= ▲

 2SO3(g) △H=-196.6 kJ·mol-1
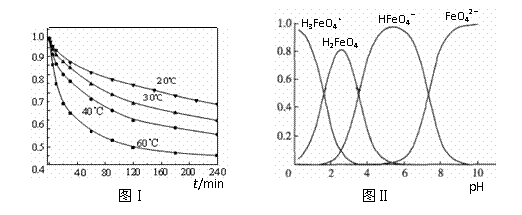
2SO3(g) △H=-196.6 kJ·mol-1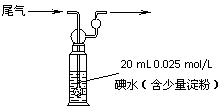 (3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。该温度下反应2SO2(g)+O2 (g)
(3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。该温度下反应2SO2(g)+O2 (g)

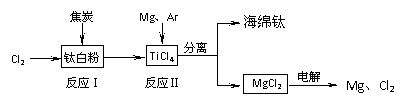 (10分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
(10分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程: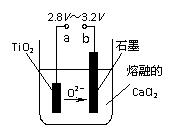 (2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ▲ ;反应Ⅱ的热化学方程式为 ▲ 。
(2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ▲ ;反应Ⅱ的热化学方程式为 ▲ 。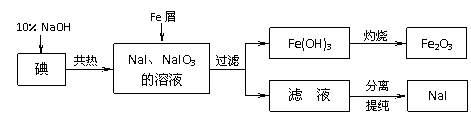 (10分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(10分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题: