22.(20分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有
___________________________、_______________________________
(2)硫酸铜溶液可以加快氢气生成速率的原因是________________________________
______________________
(3)要加快上述实验中气体产生的速率,还可采取的措施有______________________
_________________________________________(任意答一种)。
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体。记录获得相同体积的气体所需时间。
 实验
实验混合溶液 |
A |
B |
C |
D |
E |
F |
|
4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=______,V6=______,V9=______。
②反应一段时间后,A中金属表面是呈_______色,E中的金属表面呈_______色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高;但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。
请分析当加入的CuSO4溶液超过一定量时,氢气生成速率下降的主要原因是______
_________________________________________。
21.(10分)某化学兴趣小组的学习卤素以后,做了下列实验:
向滴有淀粉的KI溶液中滴加氯水,溶液出现蓝色;继续滴加氯水,溶液蓝色逐渐变浅最后变为无色。
(1)滴加氯水时溶液出现蓝色的离子方程式是____________________________。
(2)对于继续滴加氯水,溶液蓝色逐渐变浅最后变为无色的原因,请完成以下实验探究过程。
Ⅰ、提出假设
假设1:I2被氧化。
假设2:淀粉和I2都被氧化。
假设3:__________。
Ⅱ、实验设计
|
实验步骤 |
预期现象与结论 |
|
|
|
|
|
|
Ⅲ、问题与讨论
实验表明I2被氧化是蓝色消失的原因,化学方程式是:_____+____+____== HIO3+_____。
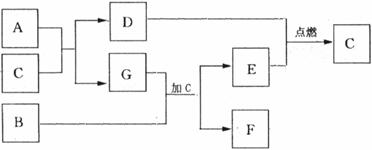
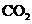 气体,发生反应的离子方程式是:
气体,发生反应的离子方程式是: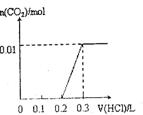 ②将少量的“三酸”与滴入纯碱溶液中
______________________;
②将少量的“三酸”与滴入纯碱溶液中
______________________;