26.(11分) 10℃时加热NaHCO3饱和溶液,测得溶液中的pH发生如下变化:
|
温度 |
10℃ |
20℃ |
30℃ |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为_______________________________________________。
乙同学认为,溶液的pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_____________(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式是________________________________________________。
丙同学认为甲、乙的判断都不充分,认为:
(1) 只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确。试剂X是___________
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清的石灰水
(2)将加热后的溶液再冷却到10℃,若溶液的pH__________8.3(填“高于”、“低于”或“等于”),则__________(填“甲”或“乙”) 判断正确。
(3) 查阅资料发现NaHCO3的分解温度为150℃,丙断言不再做任何实验也可判断,请你分析甲乙谁的观点错误,为什么?____________________________________________________________________
____________________________________________________________________。
 的高分子材料。这种锂离子电池的电池反应为:
的高分子材料。这种锂离子电池的电池反应为: Li+2Li0.35NiO2
2Li0.85NiO2
Li+2Li0.35NiO2
2Li0.85NiO2 下列说法不正确的是
下列说法不正确的是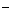 =Li
=Li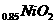 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应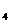 和
和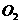 的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于
的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于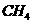 在
在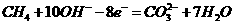
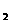 获得电子,电极反应式为
获得电子,电极反应式为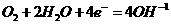
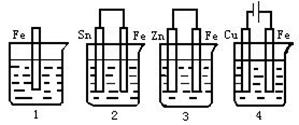
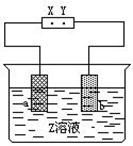
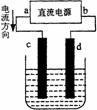 右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列
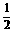 O2 (g) △H
=
+242
kJ/mol
O2 (g) △H
=
+242
kJ/mol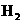 (g)+
(g)+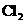 (g)==== 2HCl(g)在光照和点燃条件下的△H不同
(g)==== 2HCl(g)在光照和点燃条件下的△H不同 ( )
( )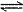 2NH3(g) ,平衡时混合气共7mol。令a、b、c分别代表N2
、H2 、NH3 起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变。则:
2NH3(g) ,平衡时混合气共7mol。令a、b、c分别代表N2
、H2 、NH3 起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变。则: