(三)酸、碱加水稀释后溶液的PH值
6、常温下,将PH=1的H2SO4溶液和PH=13的NaOH溶液分别稀释1000倍,求所得溶液的PH值。
思考:若在常温下,将PH=1的CH3COOH溶液和PH=13的NH3·H2O溶液分别稀释1000倍,则所得溶液的PH值在什么范围之内。
1.求下列溶液混合后的pH:
(1) 把pH=2和pH=4的两种强酸溶液等体积混合,其pH= 。
(2) 把pH=12和pH=14的两种强碱溶液等体积混合,其pH= 。
(3) 把pH=5的H2SO4溶液和pH=8的NaOH溶液等体积混合,其pH= 。
2.室温时,将PH=5的H2SO4溶液稀释10倍,则C(H+):C(SO42-)= ;
若再将稀释后的溶液再稀释100倍,则C(H+):C(SO42-)= 。
|
|
实验课题名称
实验测定酸碱滴定曲线 |
||||||||||||||||||||||||
|
授课时间 |
第 周星期 第__节 |
课型 |
实验课 |
主备课人 |
马丽 |
|||||||||||||||||||
|
一 .实验目标要求 1、练习使用PH计测量溶液的PH;学习以图示处理科学家实验数据的方法。 2、探究酸碱中和反应过程中PH的变化特点:体会定量试验在化学研究中的作用。 |
||||||||||||||||||||||||
|
二.实验原理 酸碱滴定曲线是以酸碱中和滴定过程中滴加酸(或碱)量为横坐标,以溶液PH为从坐标绘出的一条溶液PH随酸(或碱)的滴加量而变化的曲线。它描述了酸碱中和滴定过程中溶液PH的变化情况,其中酸碱滴定终点附近的PH突变情况(见课本P48图3-10),对于酸碱滴定中如何选择合适的酸碱指示剂具有重要意义。 三.实验用品 0.1mol/L左右的HCl溶液, 0.1mol/L左右的NaOH溶液,酚酞溶液,蒸馏水,PH计,酸式滴定管,碱式滴定管,滴定管夹,烧杯,锥形瓶,铁架台。 四.实验过程 1、实验预习(完成P51预习问题) 2、实验操作步骤 (1)检查仪器:在使用滴定管前,首先要检查活塞是否漏水,在确保不漏水后方可使用。 (2)润洗仪器:在加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管还要分别用所要盛装的酸、碱溶液润洗2-3遍。方法是:从滴定管上口加入3-5mL所要盛装的酸或碱溶液,倾斜着转动滴定管,使液体润湿全部滴定管内壁。然后,一手控制活塞(酸式滴定管轻轻转动活塞;碱式滴定管轻轻挤压玻璃球),将液体从滴定管下部放入预置的烧杯中。 (3)加入反应液:分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上2-3mL处,并将滴定管垂直固定在滴定管夹上(课本P51如图3-12所示) (4)调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液(如果滴定管内部有气泡,应快速放液以赶走气泡;除去碱式滴定管胶管中气泡的方法如课本P51图3-13),并使液面处于某一刻度,准确读取读数并记录。 (5)放出反应液:根据实验需要从滴定管中逐滴放出一定量的液体 实验操作提示: 1、 建议做本实验室采用向溶液中滴加溶液的方法,一定量(如20.00mL)的HCl溶液用酸式滴定管量取。 2、 酸碱中和滴定开始时和达滴定终点之后,测试和记录PH的间隔可稍大些,如每加入5-10mL碱,测试和记录一次;滴定终点附近;滴定终点附近,测试和记录PH的间隔要小,每加一滴测一次(如下列参考实验记录表所示)。 HCl溶液滴定NaOH溶液过程中的PH变化 温度:_______
|
||||||||||||||||||||||||
|
五.实验结果展示、交流 |
||||||||||||||||||||||||
|
六 . 完成实验报告 |
||||||||||||||||||||||||
|
七.实验中存在的问题及改进措施 |
|
第 章第 节 |
课题名称 |
水的电离和溶液的酸碱性--PH计算习题课 |
|||||
|
授课时间 |
第 周星期 第__节 |
课型 |
习题课 |
主备课人 |
马丽 |
||
|
学习目标 |
1、 了解pH的含义及其计算方法 2、 掌握不同情况下PH的计算 |
||||||
|
重点难点:掌握不同情况下PH的计算 |
|||||||
|
学 习 过 程 与 方 法 |
一、.学生自主练习: v 判断: 1、100℃时纯水的pH值为6,小于7,因而此时纯水呈酸性 2、10℃时纯水的pH值比60℃时纯水的pH值大 3、25℃相同物质的量浓度的NaOH溶液和盐酸的pH值之和为14 4、 25℃ pH=3的醋酸溶液中的[H+]与pH=11的氨水中[OH-]相等。 v 填空、选择 1、HA、HB、HC三种浓度均为0.1mol/L的一元弱酸,HA溶液的pH值为2.7,HB溶液中[OH-]=2×10-12mol/L,HC溶液中[H+]/[OH-]的值为108。则三种酸由强到弱的顺序为________。 2、有甲、乙两种溶液,甲溶液的pH值是乙溶液的两倍,则甲溶液中[H+]与乙溶液中[H+]的比值为 ( ) A、2∶1 B、100∶1 C、1∶100 D、无法确定 (1)展示交流(互相讨论、找出问题) (2)提出问题(老师引导,整体问题) |
||||||
|
二、 问题精讲: 有关pH 的计算--溶液的稀释 1、酸的稀释: v 将pH=5的醋酸溶液稀释。 ① 稀释10倍,求pH值(范围) (5,6) pH值、V相同的不同酸, 稀释相同的倍数pH弱 <pH强 ② 要使醋酸的pH值由5 变到 6,加水稀释____10倍(填< 、> 、=) >,因为稀释10倍,pH小于6,所以如pH=6,要大于10倍 练习1、pH=3的醋酸溶液加水稀释到原溶液体积的2倍,则稀释后溶液的pH值约为 ( ) A、2.8 B、3.2 C、3.3 D、4 2、 碱的稀释 v 在25℃时,pH=9的NaOH溶液稀释到10倍,pH值等于多少? [OH-]=10-5/10≈10-6 pH=-lg[H+]=-lgKW/[OH-] =-lg10-8=8 v 在25℃时,pH=9的NaOH溶液稀释到1000倍后, pH值为多少? v 向100mL纯水中加入1滴(0.05mL)0. 2mol/LBa(OH)2溶液,pH变为多少了? v pH=11的氨水稀释到pH=10,则NH3·H2O的电离平衡向_______方向移动,所得氨水的物质的量浓度 (填大于、小于或等于)原溶液浓度的1/10。 关键: 1)抓住氢氧跟离子进行计算!(先求OH-,在转换成H+ ) 2)碱提供的[OH-]很小时,不能忽略水电离出的[OH-] 3、强酸与强酸混合 在25℃时,pH=1的盐酸溶液1L与pH=4的盐酸溶液1000L混合,混合后溶液的pH值等于多少? pH=-lg[H+]=-lg[(1×10-1+1000×10-4)/(1+1000)] =-lg[2×10-4 ] =4-lg2 =3.7 关键: 1)住氢离子进行计算! 2)相加、减的两个量相差100倍以上时,小的可忽略 v pH=2的盐酸和pH=4的盐酸溶液等体积混合后,所得溶液的pH= 。 v pH=2的盐酸和pH=5的硫酸溶液等体积混合后,所得溶液的pH= 。 v pH=3的盐酸和pH=4的硫酸溶液体积比按1∶1混合后溶液的pH= 。 v 两种pH值不同的强酸等体积混合时 △pH≥2时, pH混=pH小+0.3 △pH=1 时,pH混=pH小+0. 26 |
|||||||
|
三、归纳解题方法技巧 |
|||||||
|
针 对 训 练 |
1、在25℃时,100ml
0.6mol/L的盐酸与等体积0.4mol/L的NaOH溶液混合后,溶液的pH值等于多少? 2、 在25℃时,100ml 0.4mol/L的盐酸与等体积0.6mol/L的NaOH溶液混合后,溶液的pH值等于多少? 3、把pH=13的NaOH溶液与pH=2的硫酸溶液混合后,所得溶液的pH=11,则NaOH溶液和硫酸溶液的体积之比为_____。 关键:酸过量抓住氢离子进行计算! 碱过量抓住氢氧跟离子进行计算 |
||||||
|
作业布置: |
|||||||
|
课后反思 |
|
||||||
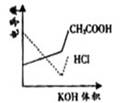 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导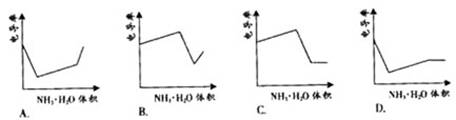
 H++OH-,向右移动且溶液呈酸性的是 ( )
H++OH-,向右移动且溶液呈酸性的是 ( )