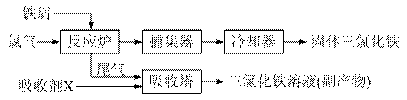
20.(12分)一般地,晶体类型不同,其结构和性质也不同。
⑴下表是四种同主族元素的氧化物的离子晶体晶格能数据。
|
氧化物 |
MgO |
CaO |
SrO |
BaO |
|
晶格能/ kJ·mol-1 |
3791 |
3410 |
3223 |
3054 |
①将上表中四种氧化物的共熔物冷却,首先析出的是 ▲ 。
②碳酸盐的热分解示意图如下图。两种碳酸盐的热分解温度CaCO3 ▲ SrCO3(填“高于”或“低于”)
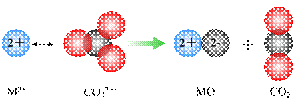
 ⑵已知NH3·H2O的电离方程式为NH3·H2O
⑵已知NH3·H2O的电离方程式为NH3·H2O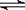 NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
①2NH3·H2O的晶体类型为 ▲ 。
②NH3极易溶于水,其主要原因是 ▲ 。
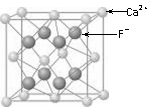
⑶CaF2的晶体结构如右图所示。
①CaF2晶体中钙离子的配位数是 ▲ 。
②一个CaF2晶胞中包含 ▲ 个钙离子。
19.(12分)为比较温室效应气体对全球增温现象的影响,科学家以CO2为相对标准,引入了“温室效应指数”的概念(如下表)。
回答下列问题:
⑴6种气体中,温室效应指数最大的物质属于 ▲ (选填“极性分子”或“非极性分子”)。
⑵在水分子中,O原子上的价层电子对数为 ▲ 。
⑶N2O4分子结构式为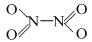 ,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
⑷O3具有吸收紫外光的功能。
①根据等电子原理,判断O3分子的空间构型为 ▲ 。
②紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: ▲ 。
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |
18.(12分)已知A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大。A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等。A、F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道。D和E原子的第一至第四电离能如下表所示:
|
电离能/ kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
D |
738 |
1451 |
7733 |
10540 |
|
E |
578 |
1817 |
2745 |
11578 |
⑴A、B、C三种元素的电负性最大的是 ▲ (填写元素符号),D、E两元素中D的第一电离能较大的原因是 ▲ 。
⑵F基态原子的核外电子排布式是 ▲ ;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于 ▲ 光谱(填“吸收”或“发射”)。
⑶根据等电子原理,写出AB+的电子式: ▲ 。
⑷已知:F3+可形成配位数为6的配合物。组成为FCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 ▲ 。
A.[CrCl (H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3] ·3H2O
|
物质 |
大气中的含量 (体积百分比) |
温室效应 指数 |
|
CO2 |
0.03 |
1 |
|
H2O |
1 |
0.1 |
|
CH4 |
2×10-4 |
30 |
|
N2O4 |
3×10-5 |
160 |
|
O3 |
4×10-6 |
2000 |
|
CCl2F2 |
4.8×10-8 |
25000 |
13.现有两种不含结晶水的盐,它们在不同温度下的溶解度如下表:
|
|
20℃ |
50℃ |
|
A的溶解度 |
35.7 g |
46.4 g |
|
B的溶解度 |
31.6 g |
108 g |
下列说法中,正确的是
A.可采用重结晶法使A、B混合物分离
B.A的溶解度一定大于B的溶解度
C.20℃时,无法配制30%的A的不饱和溶液
D.将208 g B的饱和溶液降温到20℃,析出76.4 g B
12.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是
 物质 物质选项 |
甲 |
乙 |
丙 |
|
A |
Al2O3 |
AlCl3 |
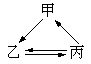 Al(OH)3 Al(OH)3 |
|
B |
CuO |
Cu(OH)2 |
CuCl2 |
|
C |
Fe |
FeCl3 |
FeCl2 |
|
D |
NaCl |
NaHCO3 |
Na2CO3 |