0 30585 30593 30599 30603 30609 30611 30615 30621 30623 30629 30635 30639 30641 30645 30651 30653 30659 30663 30665 30669 30671 30675 30677 30679 30680 30681 30683 30684 30685 30687 30689 30693 30695 30699 30701 30705 30711 30713 30719 30723 30725 30729 30735 30741 30743 30749 30753 30755 30761 30765 30771 30779 447348

 (6分)某钙钛型复合氧化物(如右图),
(6分)某钙钛型复合氧化物(如右图), ⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,
(x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,
(x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,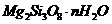 )等化合物。
)等化合物。 (1)E的基态原子的外围电子排布式为
。
(1)E的基态原子的外围电子排布式为
。
 c.N分子中含有6个 键和1个 键
c.N分子中含有6个 键和1个 键