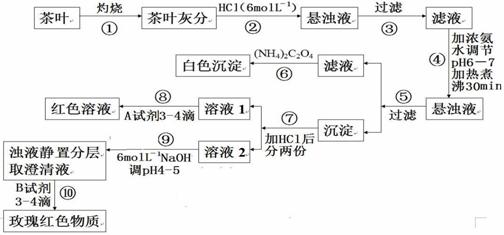
0 30242 30250 30256 30260 30266 30268 30272 30278 30280 30286 30292 30296 30298 30302 30308 30310 30316 30320 30322 30326 30328 30332 30334 30336 30337 30338 30340 30341 30342 30344 30346 30350 30352 30356 30358 30362 30368 30370 30376 30380 30382 30386 30392 30398 30400 30406 30410 30412 30418 30422 30428 30436 447348
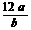
 -OH、
-OH、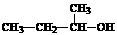 B.N原子最外层电子的轨道表示式:
B.N原子最外层电子的轨道表示式: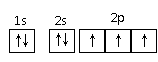 D.乙醇汽油的推广使用可以缓解石油资源短缺对经济发展造成的压力
D.乙醇汽油的推广使用可以缓解石油资源短缺对经济发展造成的压力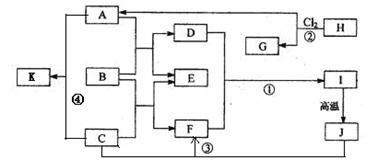 (7分)下图中B为日常生活中常见的金属,E是一种新型的清洁能源,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料, K是生理盐水主要成分(图中部分反应物或生成物没有列出)。
(7分)下图中B为日常生活中常见的金属,E是一种新型的清洁能源,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料, K是生理盐水主要成分(图中部分反应物或生成物没有列出)。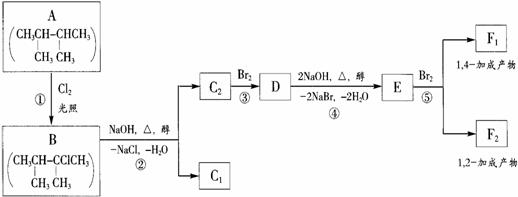
 21(9分)1mol
物质A有如下合成路线:
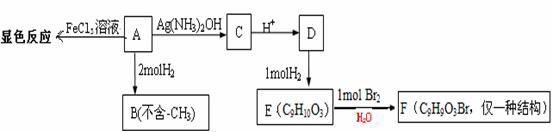
21(9分)1mol
物质A有如下合成路线: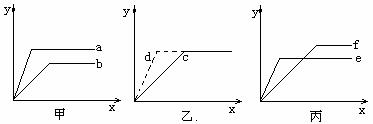
 (2)对于可逆反应:A(g)+2B(g) nC(g)+D(s) △H<0;若甲、乙、丙中的x轴都表示时间,y轴都表示反应物A的转化率。
(2)对于可逆反应:A(g)+2B(g) nC(g)+D(s) △H<0;若甲、乙、丙中的x轴都表示时间,y轴都表示反应物A的转化率。