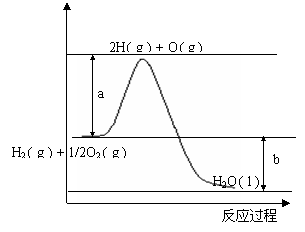
23、(10分)合成氨反应:N2(g) +3H2(g)  2NH3(g) ;ΔH=-92.4kJ·mol-1。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。
2NH3(g) ;ΔH=-92.4kJ·mol-1。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。
回答下列问题:
⑴ 合成氨工业中原料气压缩到30-50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400-500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
⑵ 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,
此时N2的转化率为x。则K和x的关系满足K= 。
⑶ 甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
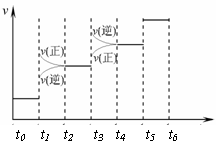 (2) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
。
(2) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
。
其中表示平衡混合物中NH3的含量最高的一段时间是 。
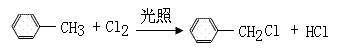
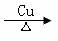
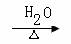
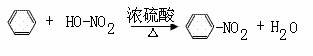
 (12分)已知:CH3COONa
+ NaOH
CH4↑+ Na2CO3
(12分)已知:CH3COONa
+ NaOH
CH4↑+ Na2CO3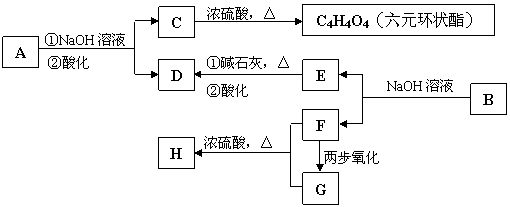

 请回答下列问题:
请回答下列问题: