25.某强酸性工业废水中含有Fe2+、Fe3+、Cu2+,设计实验方案用沉淀法除去铁离子,得到较纯的Cu2+溶液。有关氢氧化物沉淀的pH如下表:
|
金属离子 |
pH |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Cu2+ |
4.4 |
6.4 |
|
Fe3+ |
2.7 |
3.7 |
(1)从表中数据分析,为什么不能直接加NaOH将溶液pH调到9.6来除去Fe3+和Fe2+? 。
(2)实际应用中是先加一定量次氯酸钠,然后再调节pH。次氯酸钠的作用是什么? 。
(3)pH应调节到什么范围? 。 为什么? 。
(4)调节pH适宜的试剂是 (选填序号:A.氢氧化钡、B.碳酸镁、C.氧化铜、D.稀盐酸),理由是 。
答案.(1)如果直接将废水的pH从酸性调节到9.6,则铜离子也被沉淀掉,不符合题意要求(2)把Fe2+氧化成Fe3+,便于把铁杂质一次除去(3)3.7-4.4因为Fe3+在pH略大于3.7时就可完全转化为Fe(OH)3沉淀而被除去,在此pH下Cu2+尚没有开始生成沉淀 (4)C氧化铜能与溶液中的酸反应,使pH达到沉淀需要的范围,而且不引入新的杂质
23.收集多份淡水水样,如雨水、河水、池水、泉水、井水、自来水等,并从实验室取蒸馏水,进行下列实验,观察并记录现象。
|
实 验 内 容 |
蒸馏水 |
雨水 |
河水 |
井水 |
自来水 |
|
|
①过滤,看滤纸上是否有滤出物 |
|
|
|
|
|
|
|
②取滤出的清水,滴几滴在玻璃片上,小心烘干,比较玻璃片上的残留物的量 |
|
|
|
|
|
|
|
③取滤出液与明矾水混合,静置,看是否有沉淀 |
|
|
|
|
|
|
|
④取第①步滤出的水,与肥皂水混合,看是否有沉淀生成 |
|
|
|
|
|
|
答案.①过滤时,正常情况下除了河水可能有沉淀滤出,其余应该没有固体滤出; ②蒸馏水应没有残留,其他水样都会在玻璃片上留下残留物,除蒸馏水外,雨水最少,自来水次之,如果河水澄清,则应比井水少;③自然水包括井水中往往都有些悬浮杂质,故加明矾时会生成沉淀,蒸馏水和自来水不应有沉淀;④井水和河水含有钙、镁离子,加肥皂水生成沉淀注:因各自取样有特殊性,所以有些现象不一定都一样。
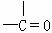 ②
②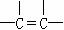 ③
③ ④
④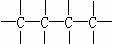
 Al(OH)3(胶体)+3H+ CaCl2、Ca(C10)2
Al(OH)3(胶体)+3H+ CaCl2、Ca(C10)2