摘要:25.某强酸性工业废水中含有Fe2+.Fe3+.Cu2+.设计实验方案用沉淀法除去铁离子.得到较纯的Cu2+溶液.有关氢氧化物沉淀的pH如下表: 金属离子 pH 开始沉淀 沉淀完全 Fe2+ 7.6 9.6 Cu2+ 4.4 6.4 Fe3+ 2.7 3.7 (1)从表中数据分析.为什么不能直接加NaOH将溶液pH调到9.6来除去Fe3+和Fe2+? . (2)实际应用中是先加一定量次氯酸钠.然后再调节pH.次氯酸钠的作用是什么? . (3)pH应调节到什么范围? . 为什么? . (4)调节pH适宜的试剂是 (选填序号:A.氢氧化钡.B.碳酸镁.C.氧化铜.D.稀盐酸).理由是 . 答案.(1)如果直接将废水的pH从酸性调节到9.6.则铜离子也被沉淀掉.不符合题意要求(2)把Fe2+氧化成Fe3+.便于把铁杂质一次除去(3)3.7-4.4因为Fe3+在pH略大于3.7时就可完全转化为Fe(OH)3沉淀而被除去.在此pH下Cu2+尚没有开始生成沉淀 (4)C氧化铜能与溶液中的酸反应.使pH达到沉淀需要的范围.而且不引入新的杂质
网址:http://m.1010jiajiao.com/timu3_id_286258[举报]
某强酸性工业废水中含有Fe2+、Fe3+、Cu2+,设计实验方案用沉淀法除去铁离子,得到较纯的Cu2+溶液。有关氢氧化物沉淀的pH如下表:

(1)从表中数据分析,为什么不能直接加NaOH将溶液pH调到9.6来除去Fe3+和Fe2+ ?_____________________。
(2)实际应用中是先加一定量次氯酸钠,然后再调节pH。次氯酸钠的作用是什么?_________________________________。
(3)pH应调节到什么范围?________________。 为什么?_________________________。
(4)调节pH适宜的试剂是_______________________
(选填序号:A.氢氧化钡B.碳酸镁C.氧化铜D.稀盐酸)
理由是______________________________。
查看习题详情和答案>>
(2)实际应用中是先加一定量次氯酸钠,然后再调节pH。次氯酸钠的作用是什么?_________________________________。
(3)pH应调节到什么范围?________________。 为什么?_________________________。
(4)调节pH适宜的试剂是_______________________
(选填序号:A.氢氧化钡B.碳酸镁C.氧化铜D.稀盐酸)
理由是______________________________。
某强酸性工业废水中含有Fe2+、Fe3+、Cu2+,设计实验方案用沉淀法除去铁离子,得到较纯的Cu2+溶液。有关氢氧化物沉淀的pH如下表:
金属离子 | pH | |
开始沉淀 | 沉淀完全 | |
Fe2+ | 7.6 | 9.6 |
Cu2+ | 4.4 | 6.4 |
Fe3+ | 2.7 | 3.7 |
(1)从表中数据分析,为什么不能直接加NaOH将溶液pH调到9.6来除去Fe3+和Fe2+? 。
(2)实际应用中是先加一定量次氯酸钠,然后再调节pH。次氯酸钠的作用是什么? 。
(3)pH应调节到什么范围? 。 为什么? 。
(4)调节pH适宜的试剂是 (选填序号:A.氢氧化钡、B.碳酸镁、C.氧化铜、D.稀盐酸),理由是 。
查看习题详情和答案>>电镀含铬废水的处理方法较多.
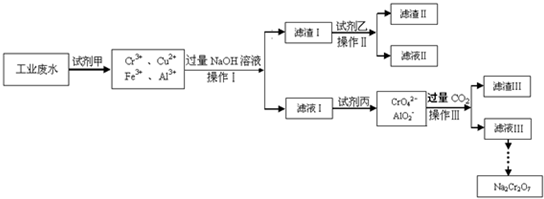
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强.为回收利用,通常采用如下流程处理:

已知:
(1)Cr(OH)3
NaCrO2
Na2CrO4
Na2Cr2O7
(2)Cu(OH)2能溶于氨水:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:(1)操作Ⅰ的名称
(2)滤渣Ⅰ的主要成分为
(3)加入试剂甲的目的
(4)废水处理流程中生成滤渣Ⅲ的离子方程式:
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在.工业上用以下方法处理处理含Cr2O72-的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准.
(5)电解时能否用Cu电极来代替Fe电极?
(6)已知某含Cr2O72-的酸性工业废水中铬元素的含量为104.5mg/L,处理后铬元素最高允许排放浓度为0.5mg/L.处理该废水1000m3并达到排放标准,至少消耗铁的质量为
查看习题详情和答案>>
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强.为回收利用,通常采用如下流程处理:

已知:
(1)Cr(OH)3
| NaOH |
| Cl2 |
| 酸化 |
(2)Cu(OH)2能溶于氨水:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:(1)操作Ⅰ的名称
过滤
过滤
,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有玻璃棒
玻璃棒
.(2)滤渣Ⅰ的主要成分为
Cu(OH)2、Fe(OH)3
Cu(OH)2、Fe(OH)3
(写化学式),试剂乙的名称氨水
氨水
.(3)加入试剂甲的目的
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
.(4)废水处理流程中生成滤渣Ⅲ的离子方程式:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
.Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在.工业上用以下方法处理处理含Cr2O72-的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准.
(5)电解时能否用Cu电极来代替Fe电极?
不能
不能
(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态
因阳极产生的Cu2+不能使Cr2O72-还原到低价态
.(6)已知某含Cr2O72-的酸性工业废水中铬元素的含量为104.5mg/L,处理后铬元素最高允许排放浓度为0.5mg/L.处理该废水1000m3并达到排放标准,至少消耗铁的质量为
336
336
kg.电镀含铬废水的处理方法较多.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强.为回收利用,通常采用如下流程处理:
已知:
(1)Cr(OH)3 NaCrO2
NaCrO2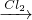 Na2CrO4
Na2CrO4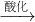 Na2Cr2O7
Na2Cr2O7
(2)Cu(OH)2能溶于氨水:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:(1)操作Ⅰ的名称______,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有______.
(2)滤渣Ⅰ的主要成分为______(写化学式),试剂乙的名称______.
(3)加入试剂甲的目的______.
(4)废水处理流程中生成滤渣Ⅲ的离子方程式:______.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在.工业上用以下方法处理处理含Cr2O72-的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准.
(5)电解时能否用Cu电极来代替Fe电极?______(填“能”或“不能”),理由是______.
(6)已知某含Cr2O72-的酸性工业废水中铬元素的含量为104.5mg/L,处理后铬元素最高允许排放浓度为0.5mg/L.处理该废水1000m3并达到排放标准,至少消耗铁的质量为______kg.
查看习题详情和答案>>
电镀含铬废水的处理方法较多.
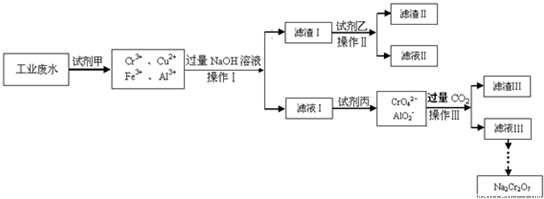
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强.为回收利用,通常采用如下流程处理:
已知:
(1)Cr(OH)3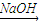 NaCrO2
NaCrO2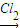 Na2CrO4
Na2CrO4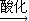 Na2Cr2O7
Na2Cr2O7
(2)Cu(OH)2能溶于氨水:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:(1)操作Ⅰ的名称______,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有______.
(2)滤渣Ⅰ的主要成分为______(写化学式),试剂乙的名称______.
(3)加入试剂甲的目的______.
(4)废水处理流程中生成滤渣Ⅲ的离子方程式:______.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在.工业上用以下方法处理处理含Cr2O72-的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准.
(5)电解时能否用Cu电极来代替Fe电极?______(填“能”或“不能”),理由是______.
(6)已知某含Cr2O72-的酸性工业废水中铬元素的含量为104.5mg/L,处理后铬元素最高允许排放浓度为0.5mg/L.处理该废水1000m3并达到排放标准,至少消耗铁的质量为______kg.
查看习题详情和答案>>
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强.为回收利用,通常采用如下流程处理:

已知:
(1)Cr(OH)3
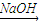 NaCrO2
NaCrO2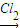 Na2CrO4
Na2CrO4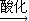 Na2Cr2O7
Na2Cr2O7(2)Cu(OH)2能溶于氨水:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:(1)操作Ⅰ的名称______,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有______.
(2)滤渣Ⅰ的主要成分为______(写化学式),试剂乙的名称______.
(3)加入试剂甲的目的______.
(4)废水处理流程中生成滤渣Ⅲ的离子方程式:______.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在.工业上用以下方法处理处理含Cr2O72-的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准.
(5)电解时能否用Cu电极来代替Fe电极?______(填“能”或“不能”),理由是______.
(6)已知某含Cr2O72-的酸性工业废水中铬元素的含量为104.5mg/L,处理后铬元素最高允许排放浓度为0.5mg/L.处理该废水1000m3并达到排放标准,至少消耗铁的质量为______kg.
查看习题详情和答案>>