32.(10分)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实 验。某研究性学习小组在实验室用中和滴定法测定某烧碱的纯度,试根据实验回答有关问题:a.将准确称取的4.4g含少量中性易溶杂质的固体烧碱配成250ml待测液;b.配制0.2000mol/L的盐酸标准液;c.用0.2000mol/L盐酸标准液滴定10.00ml待测液。
(1)滴定时带有玻璃活塞的滴定管盛放 ;以甲基橙为指示剂滴入待测液,当溶液颜色由 变为 ,30秒内不变色,表示达到滴定终点。
(2)根据下表数据计算烧碱溶液的物质的量浓度是 ;原固体烧碱的质量分数是 。
|
滴定次数 |
待测液体积(ml) |
标准酸液的体积 |
|
|
滴定前的刻度(ml) |
滴定后的刻度(ml) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
(3)下列有关说法中正确的是______________
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL 的稀盐酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大;
E.配制溶液量取较浓盐酸时,若在最后一次读数时俯视读数,则导致实验结果偏大。
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大。
G..若固体烧碱中含杂质Na2CO3,则则导致实验结果偏大。
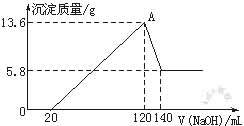 (1)求合金中Mg与Al的物质的量之比?
(1)求合金中Mg与Al的物质的量之比?
 H++A2-回答下列问题:
H++A2-回答下列问题: