16、(12分)在25mL 0.1mol·L-1 盐酸溶液中滴入0.2mol·L-1 NaOH溶液,以酚酞为指示剂。(1)填写下表中所有空格:(计算结果保留一位小数)
|
①加入NaOH溶液的体积(mL) |
5.0 |
7.5 |
10.7 |
12.0 |
12.3 |
a |
12.8 |
13.0 |
b |
17.5 |
20.0 |
|
②溶液pH |
1.3 |
1.5 |
2.0 |
2.6 |
3.0 |
7.0 |
11.2 |
11.4 |
12.0 |
12.4 |
12.5 |
|
③指示剂的颜色 |
无 |
无 |
无 |
无 |
无 |
粉红 |
红 |
红 |
红 |
红 |
红 |
a mL 、 b mL
(2)根据上表中的数据,在下图格纸中,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图。(坐标中pH变化及体积变化要标明)
|
0 5 10 15 20
(3)在实验中,必不可少的玻璃仪器是___________________________ _____。
(4)进行中和滴定操作时,眼睛注视__ _
滴定终点的判断依据是______________________ _____________。
(5)在操作中,锥形瓶用蒸馏水洗净后,未经干燥即进行滴定造成测定结果 填(“偏高”、“偏低”、“无影响”)
|
金属离子 |
PH值 |
|
|
开始沉淀 |
完全沉淀 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Zn2+ |
7.6 |
8.3 |
|
Cu2+ |
5.8 |
7.5 |
|
Al3+ |
4.0 |
5.4 |
|
Fe3+ |
2.7 |
3.7 |
15、(8分)工业上采用湿法炼锌过程中, 以ZnSO4为主要成分的浸出液中,有Fe3+、Fe2+、Al3+、Cu2+、Cd2+、Cl-等杂质,这些杂质对下一道锌的电解工序有妨碍,必须事先除去。要将溶液中的Fe2+、Cu2+、Al3+、Fe3+沉淀为氢氧化物,需溶液的pH分别为9.6、7.5、5.4 、3.7。数据如右图
现有下列试剂:① KMnO4;②NaOH;③ZnO;④H2O2;⑤Zn;⑥Fe;⑦AgNO3;⑧Ag2SO4;⑨H2SO4
根据要求将合适的试剂的序号填入下面的空格:
(1) 用 将Fe2+离子氧化成Fe3+离子,
相应的离子方程式为 。
(2) 用 调节浸出液的pH = 5.5时, 、 等形成氢氧化物沉淀而除去。
(3) 用 除去Cu2+和Cd2+离子。 用 除去Cl-离子。
13、如下表,为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是 ( )
|
序号 |
不纯物 |
除杂试剂 |
分离方法 |
|
A |
CH4(C2H4) |
酸性KMn04溶液 |
洗气 |
|
B |
NH4Cl溶液(FeCl3) |
NaOH溶液 |
过滤 |
|
C |
福尔马林(甲酸) |
Na2CO3溶液 |
蒸馏 |
|
D |
苯(苯酚) |
溴 水 |
分液 |
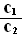 常温下,pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5 的Al2(SO4)3
常温下,pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5 的Al2(SO4)3 (3)恒温、恒压下,在一个可变容积的容器中发生如下反应: A(g) +
B (g) C (g)
。
(3)恒温、恒压下,在一个可变容积的容器中发生如下反应: A(g) +
B (g) C (g)
。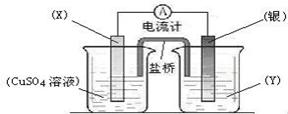 (6分)、依据氧化还原反应:2Ag+(aq) +
Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
(6分)、依据氧化还原反应:2Ag+(aq) +
Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题: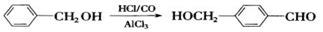 (2)
(2)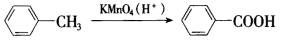 现有物质A~I的转化关系如下图:
现有物质A~I的转化关系如下图:
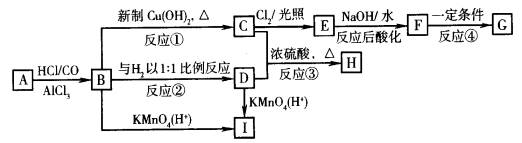 若B的分子式为C8H8O,其苯环上的一元取代物只有两种;G为高分子化合物。
若B的分子式为C8H8O,其苯环上的一元取代物只有两种;G为高分子化合物。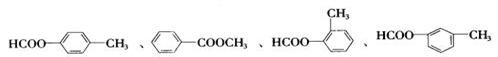
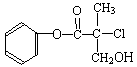
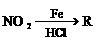 -
-

 A.有机物A属于芳香烃
A.有机物A属于芳香烃 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 后,使c、d两点短路.下列叙述正确的是
( )
后,使c、d两点短路.下列叙述正确的是
( ) 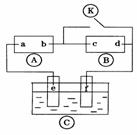 A.a为直流电源的负极
A.a为直流电源的负极 3
C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.30mol/L。下列判断中正确的是
( )
3
C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.30mol/L。下列判断中正确的是
( )